ÁREA: IC-Iniciação Científica
TÍTULO: SÍNTESE E AVALIAÇÃO DA ATIVIDADE FITOTÓXICA DE LACTONAS SESQUITERPÊNICAS DERIVADAS DA ALFA-SANTONINA
AUTORES: RODRIGUES, F. F.1*, ARANTES, F. F. P.1, BARBOSA, L. C. A.1, MALTHA, C. R. A.1, DEMUNER, A. J.1 .
1UNIVERSIDADE FEDERAL DE VIçOSA, AV. PH. ROLFS S/N – VIçOSA – MG. CEP: 36570-000. DEPARTAMENTO DE QUíMICA – LABORATóRIO DE ANáLISE E SíNTESE DE AGROQUíMICOS (LASA). *FARIARODRIGUES@YAHOO.COM.BR
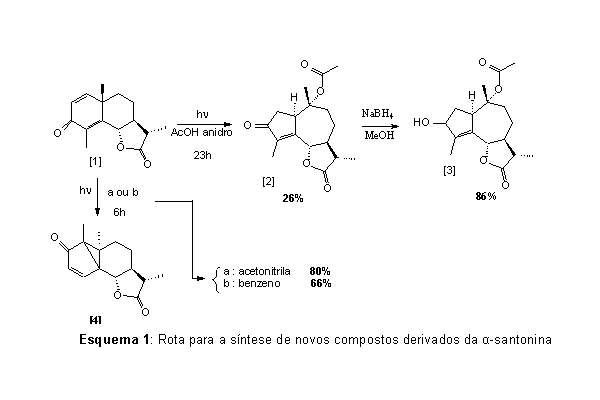
RESUMO: O controle de plantas daninhas é essencial para garantir a qualidade e produtividade das culturas. O uso de herbicidas é geralmente o método de controle mais confiável e de menor custo (HEAP, 1997). Lactonas sesquiterpênicas apresentam um amplo espectro de atividade biológica com potencial para utilização em medicina e na agricultura (BARGUES et al., 2002). Neste trabalho, foram sintetizadas as lactonas sesquiterpênicas [2], [3] e [4], conforme esquema 1. A reação fotoquímica para a síntese de [2] foi realizada em reator de borossilicato, , obtendo-se um rendimento de 26%. O composto [3] foi obtido pela redução de [2] com rendimento de 86%. A lumissantonina [4] foi obtida com um rendimento de 66 % quando se utilizou benzeno como solvente e 80% ao se utilizar acetonitrila.
PALAVRAS CHAVES: alfa-santonina, herbicidas, lactonas sesquiterpênicas.
INTRODUÇÃO: As plantas daninhas representam um problema constante na agricultura. Apesar dos modernos métodos de controle químico de plantas daninhas, perdas no rendimento e qualidade das culturas são ainda comuns, inclusive em países desenvolvidos (MACIAS, 1995).
Segundo HEAP, (1997), o uso de herbicidas é geralmente o método mais confiável e de menor custo no controle de plantas daninhas. Mas o uso desses produtos têm sido questionado devido à sua toxicidade, tanto ao homem quanto ao meio ambiente. A maioria dos produtos químicos sintéticos são bastante perigosos devido à sua grande persistência no meio ambiente, e ainda por apresentarem atividade carcinogênica e mutagênica (LEIN, 2004).
As lactonas sesquiterpênicas apresentam um amplo espectro de atividades biológicas. Os guaianolídeos representam um importante grupo dessas lactonas, com cerca de 500 compostos conhecidos de origem natural. A santonina, um eudesmanolídeo natural disponível comercialmente, pode ser utilizada como material de partida para a síntese de guaianolídeos (BARGUES et al., 2002).
Este trabalho teve como objetivo a síntese e avaliação da atividade herbicida de lactonas sesquiterpênicas derivadas da santonina [1].
MATERIAL E MÉTODOS: Neste trabalho, utilizou-se reações fotoquímicas para a síntese de lactonas sesquiterpênicas, derivadas da -santonina. Para a síntese de [2], foi utilizado um reator de borossilicato, resfriado com água à temperatura ambiente, contendo uma lâmpada de vapor de mercúrio de alta pressão (125 W) como fonte de radiação, e ácido acético anidro como solvente. O composto [3] foi obtido pela redução de [2] com boroidreto de sódio em metanol anidro. Finalmente, para a síntese do composto [4], a -santonina foi submetida à reação fotoquímica, na qual utilizou-se um reator de quartzo, contendo quatro lâmpadas de vapor de mercúrio de baixa pressão (4 x 15 W) como fonte de radiação. Nesta etapa utilizou-se acetonitrila ou benzeno como solvente da reação.
As reações foram acompanhadas por meio de cromatografia em camada delgada (CCD). Os produtos foram isolados por meio de cromatografia em coluna utilizando-se sílica gel como fase estacionária.
Os compostos produzidos durante as etapas de síntese foram identificados por Espectroscopia no IV, RMN de 1H, RMN de 13C e Espectrometria de massas.
RESULTADOS E DISCUSSÃO: As reações para o preparo de compostos derivados da alfa-santonina [1] foram realizadas de acordo com o Esquema 1.
Na tentativa de síntese de [2] foram utilizados reatores de quartzo e de borossilicato. Utilizando o reator de borossilicato e ácido acético anidro, houve a formação de uma mistura complexa de compostos, e o composto [2] foi isolado com rendimento de 26 %. Ao se utilizar o reator de quartzo, houve também a formação de uma mistura muito complexa de produtos, não sendo formado o composto [2]. Nesta síntese, o esqueleto eudesmanolídeo da alfa-santonina se transforma no esqueleto guaianolídeo através de rearranjos fotoquímicos do sistema cross-conjugado da dienona da alfa-santonina (BARGUES et al., 2002).
O composto [3] foi obtido pela redução de [2] com boroidreto de sódio (NaBH4) em metanol, com rendimento de 86%.
Para a síntese da lumissantonina [4], obtida por rearranjo intramolecular no estado excitado, foi utilizado o reator de quartzo. Nessa reação, foi realizado um estudo sobre o efeito da variação do solvente (acetonitrila ou benzeno) sobre o rendimento da reação. O rendimento da reação em benzeno foi de 66 %, e de 80 % em acetonitrila.
CONCLUSÕES: Os rendimentos obtidos na síntese dos compostos [3] e [4] foram superiores ao rendimento para o preparo do composto [2]. Nesse estudo foi feita a avaliação do efeito do solvente sobre o rendimento da reação fotoquímica para o preparo da lactona [4], observando-se uma pequena variação no rendimento quando variou-se o solvente. Os compostos sintetizados serão submetidos a ensaios biológicos para avaliação da atividade herbicida.
AGRADECIMENTOS:Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e à Fundação de Amparo a Pesquisa do Estado de Minas Gerais (FAPEMIG).
REFERÊNCIAS BIBLIOGRÁFICA:BARGUES, V , BLAY, G. , CARDONA, L. , GARCIA, B. , PEDRO, J. R. ,. Stereoselective Synthesis of (+)-11H,13-Dihydroestafiatin, (+)-11H,13-Dihydroludartin, (-)-Compressanolide , and (-)-11H,13-Dihydromicheliolide from santonin. J. Nat. Prod., 65, p. 1703 – 1706, 2002.
HEAP, I. M. The ocurrence of herbicide – resistant weeds worldwide. Pesticide Science, v. 51, p. 235-243, 1997.
LEIN, W.; BORNKE, F.; REINDL, A.; EHRHARDT, T.; STITT, M.; SONNEWALD, U. Target-based discovery of novel herbicides, &: 219-225, 2004.
MACIAS, F. A. Allelopathy: organisms, processes, and applications. Chapter 23: Allelopathy in the Search for Natural Herbicide Models. American Chemical Society, Washington, DC 1995.
