ÁREA: Iniciação Científica
TÍTULO: ESTUDO COMPUTACIONAL DA REATIVIDADE DOS PRODUTOS ISOMÉRICOS EM REAÇÕES DE HALIDRIFICAÇÃO ATRAVÉS DA ANÁLISE DOS ORBITAIS DE FRONTEIRAS – HOMO E LUMO
AUTORES: Lobato, C.C. (UNIFAP) ; Silva, E.M. (UNIFAP) ; Vieira, J.B. (UNIFAP) ; Macêdo, W.J.C. (UNIFAP) ; Costa, E.V.M. (UNIFAP) ; Carvalho, J.C.T. (UNIFAP) ; Santos, C.B.R. (UNIFAP)
RESUMO: A química computacional vem conquistando seu espaço entre as metodologias que
investigam os fenômenos químicos, pois permite obter resultados altamente
confiáveis de cálculos de propriedades. Os métodos que utilizam as energias do
orbital molecular mais alto ocupado (HOMO) e do orbital molecular mais baixo
desocupado (LUMO) têm sido utilizados nos cálculos de diversos parâmetros tais
como: índice de reatividade química, afinidade eletrônica e potencial de
ionização. Este trabalho teve como objetivo estudar a reatividade e estabilidade
de produtos isoméricos em reações de halidrificação através da análise dos
orbitais HOMO e LUMO. O produto mais estável, dentre os investigados, foi 2-
Iodo-2-Metilpropano, onde a variação entre o mais estável de cadeia normal e
ramificada foi de 1,067%.
PALAVRAS CHAVES: Reação de halidrificação; Métodos computacionais; Orbitais de fronteira
INTRODUÇÃO: Nas últimas décadas, a química computacional vem conquistando seu espaço entre
as metodologias que investigam os fenômenos químicos, pois permite obter
resultados altamente confiáveis de cálculos de propriedades, sendo aplicadas com
sucesso para estudo de uma ampla faixa de problemas de interesse químico, como
cinética de reação, propriedades magnéticas, reatividade e estabilidade
conformacional (ARROIO et al, 2010). Os métodos que utilizam orbitais
moleculares têm sido utilizados nos cálculos de diversos parâmetros de interesse
químico e farmacológico. Em geral, são utilizadas as energias do orbital
molecular mais alto ocupado (HOMO) e do orbital molecular mais baixo desocupado
(LUMO). A energia do HOMO mede o caráter elétron-doador de um composto e a
energia do LUMO mede o caráter elétron-acei¬tador. Destas definições, duas
características importantes podem ser observadas: 1) quanto maior a energia do
HOMO, maior a capacidade elétron-doadora; 2) quanto menor a energia do LUMO
menor será a resistência para aceitar elétrons. As energias do HOMO e do LUMO
têm sido usadas há algumas décadas como índices de reatividade química e são
comumente correlacionadas com outros índices, tais como: afinidade eletrônica e
potencial de ionização (GRANT, 1996). A diferença entre as energias dos orbitais
HOMO-LUMO é chamada de GAP, sendo um importante indicador de estabilidade
molecular. Moléculas com baixo valor de GAP são reativas, enquanto moléculas com
alto valor de GAP indicam alta estabilidade da molécula, logo apresenta baixa
reatividade nas reações (ZHANG, 2007). Deste modo, este trabalho teve por
objetivo estudar a reatividade dos produtos isoméricos em reações de
halidrificação em alcenos através da análise dos Orbitais Moleculares de
Fronteiras (OMF) – HOMO e LUMO.
MATERIAL E MÉTODOS: O estudo computacional foi desenvolvido para reações de halidrificação em
alcenos, utilizando dois substratos (2-buteno e 2-metilpropeno) e quatro
reagentes (HF, HCl, HBr e HI), para investigar a reatividade dos produtos
isoméricos de cadeia dos halogênios (C4H9F, C4H9Cl, C4H9Br e C4H9I). Os
substratos, reagentes e produtos foram construídos com auxílio dos programas
ChemSketch (ACD, 2010). Os cálculos de otimização de geometria foram realizados
com o programa HyperChem Release 6.02 (CHEMPLUS, 2000) em um computador com
proces¬sador Core 2 Duo (3 GHz), com 4,00 Gb de RAM. Os parâmetros energéticos:
energia total, energia nuclear, energia eletrônica, energia dos orbitais
moleculares de fronteiras (HOMO e LUMO) e a diferença de energia entre os
orbitais HOMO e LUMO (GAP), foram utilizadas para correlacionar estrutura,
estabilidade e a reatividade das moléculas, sendo obtidos pelo método ab initio
Hartree-Fock (HF) com o conjunto de base 3-21G. A energia total foi utilizada
para estimar a estabilidade dos produtos, e corresponde a soma da energia de
repulsão nuclear com a energia eletrônica. A energia eletrônica foi determinada
mediante a aproximação de Born-Oppenheimer assumindo-se uma posição fixa dos
núcleos, e a equação de Schrödinger foi resolvida a fim de se encontrar a
energia eletrônica das moléculas. A densidade eletrônica e a orientação espacial
dos Orbitais Moleculares de Fronteiras (OMF) – HOMO e LUMO, foram visualizados
através da interface do mesmo programa.
RESULTADOS E DISCUSSÃO: Para elucidar o mecanismo de halidrificação foram calculados os descritores
relacionados às energias dos OMF, com a finalidade de verificar a estabilidade
das moléculas estudadas em função dos seus GAPs de energia.Considerando que
quanto menor o valor de GAP,menor será a estabilidade da molécula,e quanto maior
o valor de GAP, mais estável será a molécula.Sendo assim,a estabilidade da
molécula é diretamente proporcional ao valor de GAP.De acordo com a Tabela
1,podemos notar que as energias do HOMO e LUMO para o composto mais estável
foram de -9,34977eV e 3,10104eV (2-Iodo-2-Metilpropano),e para o composto menos
estável foram -12,54463eV e 7,17995eV (2-Fluorbutano),onde os valores de GAP
para essas moléculas são -12,45082eV e -19,72458eV,respectivamente.Ao analisar
os produtos de cadeia normal,verificamos que a molécula 2-Iodobutano apresentou
maior valor de GAP -12,58517eV.Entretanto,a molécula 2-Fluorbutano obteve menor
valor de GAP -19,72458eV.Ao subtrair os GAPs da molécula mais estável do menos
estável de cadeia normal,obtivemos uma variação de 7,13941eV,que corresponde a
36,195% a mais de estabilidade do 2-Iodobutano em relação ao 2-
Fluorbutano.Dentre os produtos de cadeia ramificada,o 2-Iodo-metilpropano
apresentou maior valor de GAP -12,45082eV,e o 2-Fluor-2-metilpropano obteve
menor valor de GAP -19,39828eV.A diferença entre os valores de GAP da molécula
mais estável e do menos estável de cadeia ramificada,apresentou uma variação de
6,94745eV,que corresponde a 35,814% a mais de estabilidade do 2-Iodo-2-
metilpropano em relação ao 2-Fluor-2-metilpropano.O composto mais estável é o 2-
Iodo-2-Metilpropano,onde a variação entre o mais estável de cadeia normal e
ramificada é de 1,067%.A Figura 1 mostra a densidade eletrônica dos OMF para
reação do composto mais estável.
Tabela 1
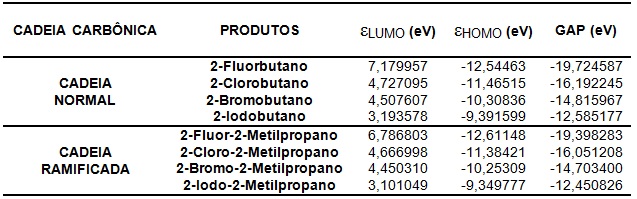
Energia dos orbitais moleculares de fronteiras e
GAP.
Figura 1.
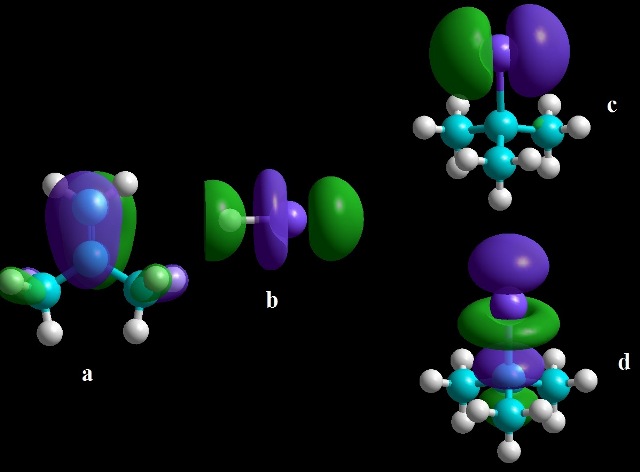
Orientação dos orbitais a) HOMO do 2-metilpropeno e
b) LUMO do iodeto de hidrogênio para formação do c)
HOMO e d) LUMO do 2-Iodo-2-metilpropano.
CONCLUSÕES: Neste estudo foram apresentados conceitos de orbitais de fronteira pelo uso da
química computacional, que possibilita o aprofundamento da teoria através de
cálculos químico-quânticos. Após calcular as energias dos orbitais de fronteira
para os compostos, calculou-se os GAPs a fim de obter a molécula mais estável. O
composto mais estável foi o 2-Iodo-2-Metilpropano, quando comparados com os GAPs
dos compostos isoméricos analisados. O mapa de densidade eletrônica mostrou a
interação entre os orbital HOMO do substrato e o orbital LUMO do reagente na
reação de formação do composto mais estável.
AGRADECIMENTOS: Universidade Federal do Amapá - UNIFAP
Ao Laboratório de Fármacos pela Infra-Estrutura
REFERÊNCIAS BIBLIOGRÁFICA: ACD/CHEMSKETCH FREWARE, version 12.00. Advanced Chemistry Development, Inc., Toronto, ON, Canadá, www.acdlabs.com, 2010
ARROIO, A.; HONÓRIO, K. M.; SILVA, A. B. F. Propriedades químico-quânticas empregadas em estudos das relações estrutura-atividade. Química Nova, Vol. 33, No. 3, 694-699. 2010
CHEMPLUS: Modular Extensions for HyperChem Release 6.02, Molecular Modeling for Windows, HyperClub, Inc., Gainesville, 2000.
GRANT, G. H.; RICHARDS, W. G. Computational Chemistry. Oxford Science Publications. 1996.
ZHANG, G.; MUSGRAVE, C.B.; Comparison of DFT Methods for Molecular Orbital Eigenvalue Calculations, J. Phys. Chem. A. 111, 1554-1561. 2007.
