ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Cavalcanti, L.P.A.N. (IME) ; Lima, J.A. (UNIGRANRIO, UFRJ) ; Aguiar, A.P. (IME) ; Lima, A.L.S. (IME)
Resumo
Oximas podem ser utilizadas na reativação ou proteção da enzima contra intoxicação por organofosforados; aos quais são atribuídos mais de três milhões de casos de intoxicações. Este trabalho descreve a síntese de oximas (50 – 95%) a partir de derivados carbonilados ou com grupo nitrila, os quais foram tratados com hidroxilamina. As oximas, em diferentes concentrações, tiveram suas capacidades de inibir acetil e butirilcolinesterase avaliadas por cromatografia em camada delgada. As oximas derivadas de 3-metoxibenzaldeído, 1,3-benzodioxol-5- carbaldeído, 4-piridinacarbaldeído inibiram seletivamente AChE, enquanto as derivadas de 4-nitrobenzaldeído, 2-clorobenzaldeído e 4-cianopiridina inibiram ambas as enzimas. Paration e Pralidoxima foram os controles.
Palavras chaves
Oximas; Anticolinesterásicos; Cromatografia
Introdução
Os compostos organofosforados (OP) podem ser usados como defensivos agrícola ou arma química. Esta última aplicação tem sido favorecida pela sua toxicidade, volatilidade e lipofilicidade (NURULAIN, 2011). Estes agentes induzem seus efeitos tóxicos por inibição irreversível das enzimas acetilcolinesterase (AChE) e butirilcolinesterase (BChE), levando a um acúmulo do neurotransmissor acetilcolina (ACh) nas sinapses centrais e periféricas. Isto resulta em broncorréia, fasciculação muscular e cardíaca, convulsões, depressão respiratória e morte (TANOS et al., 2010; EVISON et al., 2002). A estratégia terapêutica padrão para exposição aguda a OP inclui o uso de atropina (anticolinérgico), oximas (reativadores de AChE), benzodiazepínicos (anticonvulsivantes). É a melhor estratégia que se tem, há 59 anos, deficitária e insuficiente para combater a toxicidade dos OP na maioria dos casos (PETROIANU et al, 2012). Dos muitos reativadores de AChE desenvolvidos, apenas a pralidoxima e a obidoxima são usadas clinicamente, embora sejam ineficazes contra alguns OP (EYER & WOREK, 2007). A capacidade de reativação da AChE pelas oximas é limitada pela ocorrência de “envelhecimento do complexo OP-AChE” (BHARATE et al, 2010). Além de reativadores, oximas são também inibidores reversíveis da AChE e, portanto, podem proteger o sítio catalítico contra a fosforilação, por competição direta entre a oxima e o OP (SIMEON-RUDOLF et al., 1998). A interação OP-BChE ocorre de forma similar à com AChE. O objetivo deste trabalho foi sintetizar e avaliar por ensaio bioguiado, derivados de oximas obtidos a partir de aldeídos, cetona e grupo ciano, com potencial de inibição da AChE e da BChE, condição necessária para se obter moléculas capazes de proteger o sítio ativo das enzimas.
Material e métodos
As oximas foram sintetizadas a partir dos reagentes: 4-hidroxi-3- metoxibenzaldeído (1), 4-nitrobenzaldeído (2), 2-clorobenzaldeído (3) 1,3- benzodioxol-5-carbaldeído (4), 4-piridinacarbaldeído (5) e 4-cianopiridina (6) e -ionona (7). Em um balão de 50 mL foram adicionados o aldeído (6 mmol), água destilada (6 mL), etanol (20 mL), e cloridrato de hidroxilamina (6 mmol). Foram utilizados três diferentes procedimentos: a) Micro-ondas: P = 80 W durante 10 a 20 min; b) Temperatura ambiente: 25 ºC / 24 h com agitação constante; c) Ultrassom: O meio a 60 ºC foi irradiado por 4 h. As reações foram monitoradas por CCD (hexano:acetato de etila 1:1) até o desaparecimento total dos reagentes. Após o período reacional o meio orgânico foi extraído com diclorometano (3 x 25 mL) e a fase orgânica seca com sulfato de sódio. O solvente foi removido a pressão reduzida e o resíduo foi purificado por cromatografia flash em coluna. Os produtos foram caracterizados por ponto de fusão, IV, CG-EM e RMN de H¹ e C¹³. Ensaios de inibição enzimática: Foi utilizado o método de Ellman adaptado por RHEE et al (2003a) para CCD. Utilizou-se placas de sílica, nas quais foram aplicadas as amostras (2 µL) em diferentes concentrações (0,01 a 100 mM), os controles (2 µL) de OP (paration) e oxima (pralidoxima), ambos nas concentrações de 0,01 mM e o solvente das amostras (metanol ou água; 2 µL). Após aplicação, aspergia-se o reagente de Ellman e o substrato da enzima (1:1; 2 mM) por toda a placa. Esperava-se reduzir o excesso de líquido e então, aspergia-se a enzima- teste (3 U). Os halos em branco eram indicativos de inibição da enzima. Para confirmar o resultado, o teste do falso-positivo foi realizado. Pontos brancos eram indicativos de falso-positivo (RHEE et al.,2003b).
Resultado e discussão
Como oximas aromáticas são reportadas como potenciais reativadores de AChE foram
selecionados cinco aldeídos, uma cetona e um ciano-derivado de modo a
investigar se as respectivas oximas seriam capazes de proteger / reativar as
enzimas AChE e BChE. Foram utilizados seis reagentes aromáticos (1-6) e um
alifático (7) com o objetivo de observar a influência do radical aromático no
processo. Dentre os compostos aromáticos foram empregados dois sistemas
derivados da piridina (5 e 6), os quais forneciam derivados de oximas com
estruturas análogas a pralidoxima. Os aldeídos 1 – 4 foram utilizados estudar a
influência dos substituintes e das densidades eletrônicas do anel no processo.
Os reagentes foram tratados com NH2OH.HCl, originando as oximas 8 a 14 (50 a
95%), respectivamente. Os produtos foram caracterizados pelos pontos de fusão
(Figura 1) e através dos espectros de IV, CG-EM e RMN. As oximas 8, 11 e 12
inibiram seletivamente AChE, enquanto as oximas 9, 10 e 13 inibiram ambas as
enzimas. Embora as oximas 8 e 11 apresentaram seletividade, as mesmas só
inibiram a AChE na concentração de 100 mM, enquanto a oxima 12, inibiu na
concentração de 1 mM. A oxima 9 inibiu a AChE apenas na concentração de 100 mM,
e inibiu a BChE na concentração de 0,1 mM, parecendo ter maior seletividade para
a BChE. Já as oximas 10 e 13 inibiram ambas as enzimas de modo não seletivo,
sendo que 10 inibiu as enzimas na concentração de 0,1 mM, enquanto 13 inibiu-as
na concentração de 0,01 mM, concentração igual à dos controles. A oxima 14
apresentou resultado falso-positivo para ambas as enzimas. Devido aos resultados
promissores, as oximas 10, 12 e 13 foram selecionadas para dar continuidade aos
estudos, agora quantitativos, de reativação e proteção da atividade enzimática,
contra o OP Paration.
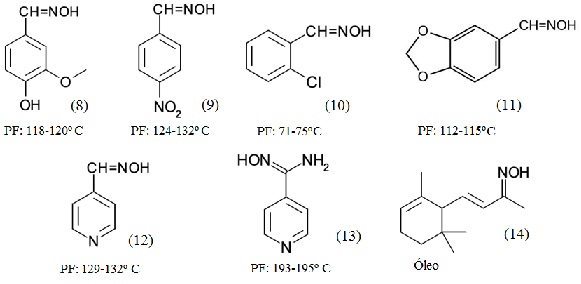
Oximas sintetizadas e seus pontos de fusão (Fonte: CHEMICAL BOOK; CHEMBASE).
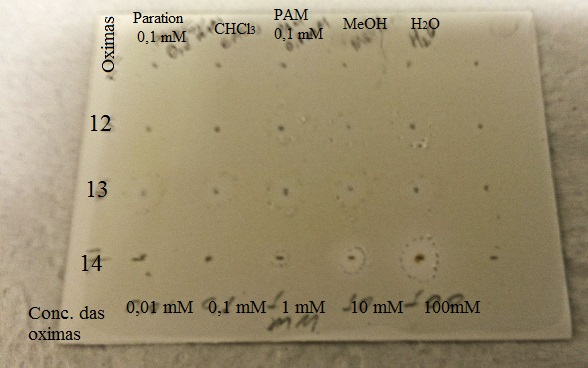
Ensaio bioguiado de inibição da AChE pelas oximas 12, 13 e 14 nas concentrações de 0,01 mM a 100 mM. Os círculos em branco indicam a inibição.
Conclusões
Os resultados indicam que oximas neutras podem ter um potencial emprego no processo de proteção de AChE e BChE. O processo foi influenciado pela natureza do substituinte e pela densidade eletrônica do anel aromático. A oxima 13 forneceu o maior espectro de atividade inibitória frente as enzimas AChE e BChE. Embora as oximas sintetizadas sejam reportadas na literatura, este é o primeiro estudo bioguiado das mesmas, visando o desenvolvimento de reativadores e protetores enzimáticos.
Agradecimentos
A CAPES pelo financiamento da pesquisa, a FIOCRUZ pelas análises por RMN.
Referências
BHARATE, S. B.; GUO, L.; REEVES, T.R; CERASOLI, D. M.; THOMPSON, C. M. Bisquaternary pyridinium oximes: Comparison of in vitro reactivation potency of compounds bearing aliphatic linkers and heteroaromatic linkers for paraoxon-inhibited electric eel and recombinant human acetylcholinesterase. Bioorganic & Medicinal Chemistry. v.18, 787–794, 2010.
CHEMICAL BOOK, Disponível em: www.chemicalbook.com (Acessado em:20/01/2014).
CHEMBASE, Disponível em: http://en.chembase.cn (Acessado em: 25/01/2014).
EYER, P.; WOREK, F. Oximes. In T. C. Marrs, R. L. Maynard, F. R. Sidell (Eds.), Chemical Warfare Agents: Toxicology and Treatment, 305–329. Chichester: John, 2007.
NURULAIN, S. M. Efficacious Oxime for Organophosphorus Poisoning: A Minireview. Tropical Journal of Pharmaceutical Research, v.10, n. 3, 341-349, 2011.
PETROIANU, G. A.; LORKE, D. E. ; KALASZ, H. Comparison of the Ability of Pyridinium Aldoximes to Reactivate Human Red Blood Cell Acetylcholinesterases Inhibited by ethyl- and methyl-paraoxon. Current Organic Chemistry v. 16, 1359-1369, 2012.
RHEE, I. K.; APPELS, N.; LUIJENDIJK, T.; IRTH, H.; VERPOORTE, R. Determining Acetylcholinesterase Inhibitory Activity in Plant Extracts Using a Fluorimetric Flow Assay. Phytochemical Analysis, n. 14, 145-149, 2003a.
RHEE, I.K.; VAN RIJN, R. M.; VERPOORTE, R. Qualitative Determination of False-positive Effects in the Acetylcholinesterase Assay using Thin Layer Chromatography. Phytochemical Analysis, n. 14, 127-131, 2003b.
SIMEON-RUDOLF, V., REINER, E., SKRINJARIC-SPOLJAR, M., RADIC, B., LUCIC, A., PRIMOZIC, I., TOMIC, S. Quinuclidiniumimidazolium compounds: synthesis, mode of interaction with acetylcholinesterase and effect upon soman intoxicated mice. Archives of Toxicology, n.72, 289–295, 1998.










