ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Vasconcelos, G.T.S. (UFPE) ; Serafim, N.B.V. (UFPE) ; Araujo, R.O. (UFPE) ; Maria, C.V.V. (UFPE) ; Sena, K.X.F.R. (UFPE) ; Albuquerque, J.F.C. (UFPE)
Resumo
Nos últimos anos as infecções bacterianas têm aumentado consideravelmente, afetando milhões de pessoas em todo mundo, resultando em elevadas taxas de morbidade e mortalidade. As tiazolidinas são compostos que apresentam atividade microbiológica e são capazes de combater esses micro-organismos. O objetivo desse trabalho foi sintetizar um derivado tiazolidínico e determinar a atividade microbiológica. O composto 5-(3-metoxi-benzilideno)-tiazolidina-2,4-diona (Ju-403) foi obtido pela reação de condensação com aldeído aromático e teve a estrutura química determinada por métodos espectroscópicos de Infravermelho, NMR1H e Massa. A atividade antimicrobiana foi testada contra nove micro-organismos de diferentes classes. Das quatro linhagens Gram-positivas testadas três forma inibidas pelo composto
Palavras chaves
Atividade antimicrobiana; tiazolidinas; derivado tiazolidínico
Introdução
A tiazolidina é representada por um anel pentagonal com enxofre e nitrogênio nas posições 1 e 3. Esse núcleo pode sofrer substituições em várias posições do núcleo tiazolidínico. Diversas reações envolvem o anel tiazolidínico como: oxidação, reações de Mannich com N-alquilação no nitrogênio do anel tiazolidínico e condensação com aldeído, cetona ou com sais de diazônio na posição 5. Suas propriedades biológicas mudam de acordo com as substituições do núcleo tiazolidínico e de acordo com os substituintes. Porém, a maior diferença na estrutura e nas propriedades é exercida pelo grupo ligado ao átomo de carbono das posições 2 e com diversos substituintes na estrutura 3. Variações nos substituintes ligados ao átomo de nitrogênio e ao de carbono metilênico são possíveis para as estruturas 2 e 3 (Figura 2) (VERMA e SARAF, 2008). As tiazolidinas podem sofrer reações de condensação do tipo aldólica envolvendo o grupo metileno na posição 5 do anel, devido ao caráter nucleófilo do carbono metilênico. A redução do caráter nucleofílico e a formação de um ânion em presença de uma base são dependentes do efeito retirador de elétrons da carbonila adjacente, bem como da presença de outros grupos retiradores de elétrons na posição 2 deste anel. A literatura descreve o método de obtenção de compostos 5-benzilideno-substituídos com bons rendimentos, por meio de uma condensação de Knoevenagel entre os núcleos correspondentes, heterocíclicos de rodanina, ácido, rodanina-N-acético, tiazolidina-2,4-diona, ácido barbitúrico e ácido tiobarbitúrico e uma série de benzaldeídos substituídos (TOMASIC et al., 2010). Teoricamente, os compostos 5-benzilideno-substituídos podem apresentar isômeros E e Z para ligação dupla exocíclica (CH=C) para o próton metileno na faixa de 7,46-7,82 ppm (Bruno, 2004).
Material e métodos
O composto 5-(3-metoxi-benzilideno)-tiazolidina-2,4-diona (Ju-403) (Figura 2) foi sintetizados a partir de quantidades equimolares de uma solução de tiazolidina-2,4-diona 0,263 g (2,25×10-3 mol) em 7, mL de etanol e duas gotas de piperidina sob agitação magnética. A seguir foi adicionado o aldeídos aromático 3-metoxi benzaldeído 0,342 g (2,25×10-3 mol). A mistura foi aquecida a 70 ºC e continuamente agitada pelo período de 10 horas e aquecida em banho de óleo. Após o término da reação o produto reacional foi resfriado em banho de gelo, o volume reduzido a metade, e o produto filtrado e recristalizado no próprio meio reacional. A atividade antimicrobiana foi avaliada frente a nove micro-organismos representantes de diferentes classes: Gram-positivos Staphylococcus aureus, Micrococcus luteus, Bacillus subtilis, e Enterococcus faecalis; Gram-negativos Pseudomonas aeruginosa, Esherichia coli, e Serratia marcescens; álcool ácido resistente Mycobacterium smegmatis e a Levedura Candida albicans. A atividade antimicrobiana foi avaliada qualitativamente pelo método de difusão em disco de papel (BAUER et al., 1966). Discos de 6 mm de diâmetros foram impregnados com uma solução do composto sintetizado em estudo e colocado sobre a superfície do meio semeado com o micro-organismo. Uma solução a 30000 µg/mL foi preparada e os discos impregnados com 10 µL da amostra, obtendo-se uma concentração de 300 µg em cada disco. As placas foram incubadas por 24-48 horas a 35 °C. Os resultados foram avaliados pela medição (em mm) do diâmetro do halo de inibição do crescimento do micro-organismo, formado em volta dos discos. Os testes foram realizados em duplicata e os valores foram obtidos a partir de média aritmética. Como drogas padrões foram utilizadas ampicilina (10 μg) e kanamicina (10 μg)
Resultado e discussão
Os resultados apresentados foram: Ponto de Fusão. 180-183 ºC, Rf. 0,48 no sistema (hexano e acetato de etila, 7:3. O rendimento foi 13%, que foi considerado baixo. A ligação dupla exocíclica (CH=C), apresenhtou sinal do RMN1H para o próton metileno na faixa de 7,56 ppm conforme a literatura (Bruno et al.; 2002) O infravermelho teve bandas de absorções na faixa de 1575 (C=C) e 1734-1676 (C=O) cm-1 referente a dupla ligação e às carbonilas. O massa mostrou peso molecular 235.0303. O composto foi submetido à atividade antimicrobiana pelo teste de difusão em disco de papel e apresentou halos de inibição frente aos micro-organismos analisados Gram-positivos: Staphylococcus aureus (11 mm), Micrococcus luteus (16 mm), Bacillus subtilis (10 mm) , Enterococcus faecalis não foi inibido pelo composto. O derivado tiazoldínico sintetizado não formou halos de inibição para os micro-organismos testados Gram-negativos (Pseudomonas aeruginosa, Escherichia coli, Serratia marcescens), álcool ácido resistente (Mycobacterium smegmatis) e a levedura Candida albicans. O espectro de ação foi apenas para os micro-organismos Gram-positivos sendo que os halos apresentados para os representantes desse grupo foram significativos, com exceção do micro-organismo M. faecalis que não foi inibido. Porém, foi observado que os halos formados foram inferiores àqueles apresentados a partir da droga padrão ampicilina. Estes resultados estão de acordo com dados da literatura onde mostra que a tiazolidina-2,4-diona não tem atividade antimicrobiana, porém quando é substituída na posição 5 do anel heterocíclico por um grupo arilideno apresenta atividade para micro-organismos Gram-positivos (GOUVEIA et al. 2009; SILVA et al., 2014). Das quatro linhagens Gram-positivas testadas, três foram inibidas pelo composto.
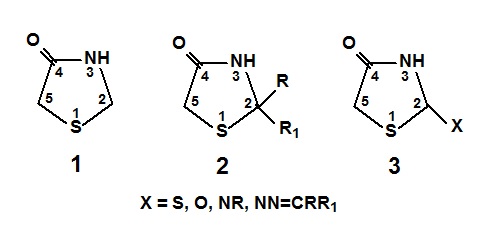
Fig. 1 Núcleo tiazolidínico e as diversas substituições na posição 2
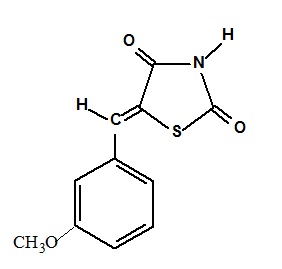
Figura 2 Estrutura química do composto 5-(3-metoxi-benzilideno)-tiazolidina-2,4-diona (Ju-403)
Conclusões
O composto foi sintetizado dentro das normas planejadas e sua atividade microbiológica foi verificada dentro da metodologia preconizada. As constantes físicas foram determinadas, incluindo rendimento, Rf e Ponto de Fusão, assim como a sua estrutura química foi comprovada pelo método espectroscópico de RMN1H. O derivado sintetizado apresentou atividade para três dos nove micro-organismos, porém os halos apresentados foram menores que os formados pelas drogas padrão. Isto nos mostra a importância da realização de reações para modificar a estrutura da molécula, visando o aumento de sua atividade.
Agradecimentos
Ao CNPq/PIBIC/UFPE pelo financiamento. Aos alunos do laboratório de Microbiologia do Depto. de Antibióticos UFPE pela cooperação nos testes realizados.
Referências
BAUER, A. W.; KIRBY, W. M. M.; SHEVIS, J. C.; TURK, M. Antibiotic susceptibility testing by a standardized single disc method. Amer. J. Clin. Pathol, 45: 493-496, 1986.
G. Bruno, L. Costantino, C. Curinga, R. Maccari, F. Monforte, F. Nicolo, R. Ottaná, and M. G. Vigorita, “Synthesis and Aldose Reductase Inhibitory Activity of 5-Arylidene-2,4-thiazolidinediones,” Bioorganic and Medicinal Chemistry, vol. 10, no. 4, pp. 1077-1084, 2002.
T. Tomašić, N. Zidar, A. Kovač, S. Turk, M. Simčič, D. Blanot, M. Müller-Premru, M. Filipič, S. G. Grdadolnik, A. Zega, M. Anderluh, S. Gobec, D.Kikelj, and L. P. Mašič, “5‐Benzylidenethiazolidin‐4‐ones as Multitarget Inhibitors of Bacterial Mur Ligases,” ChemMedChem, vol. 5, no. 2, pp 286–295, 2010.
A. Verma, and S. K. Saraf, “4-Thiazolidinone e a biologically active scaffold,”
European Journal of Medicinal Chemistry, vol. 43, no. 5, pp 897-905, 2008.
12. F. L. Gouveia, R. M. B. Oliveira, T. B. Oliveira, I. M. Silva, S. C. Nascimento, K. X. F. R. Sena, J. F. C. Albuquerque, “Synthesis, antimicrobial and cytotoxic activities of some 5-arylidene-4-thioxo-thiazolidine-2-ones,” European Journal Medicinal Chemistry, vol. 44, no. 5, pp. 2038-2043, 2009.
Silva I. M.; Silva Filho, J; Santiago P. B. G. S.; Egito M. S. Souza, C A.; Gouveia, F. L.; Ximenes, R. M. Sena, K. X. F. R.; Faria, A. R.; Brondani, D. J.; Albuquerque, J. F. C. Synthesis and Antimicrobial Activities of 5-Arylidene-Thiazolidine-2,4-dione Derivatives, BioMed Research International, v. 2014, p. 1-8, 2014.










