ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Sant' Anna, R.S. (IFF CABO FRIO) ; Matos, L.A. (IFF CABO FRIO) ; Terra, W.S. (IFF CABO FRIO) ; Oliveira, A.C.C. (IFF CABO FRIO)
Resumo
A corrosão pode ser definida como a deterioração de um material, geralmente metálico, por ação química ou eletroquímica do meio em que se encontra, aliada ou não a esforços mecânicos. A fim de se evitar essa indesejável deterioração, é imprescindível a utilização de agentes anticorrosivos. O presente trabalho tem como objetivo avaliar o efeito anticorrosivo do H2Salen [N,N-(bis- salicilideno)etilenodiamina] em um sistema composto por uma peça metálica de liga aço-carbono imersa em uma solução de ácido clorídrico e etanol.
Palavras chaves
H2Salen; Atividade anticorrosiva; potencio e condutimetria
Introdução
Desde longa data, o processo conhecido como corrosão vem causando grandes problemas em diversos setores da sociedade, principalmente nas indústrias química e petrolífera; nos meios de transportes aéreo, ferroviário, metroviário, marítimo, rodoviário; nos meios de comunicação; na odontologia (em restaurações metálicas e aparelhos de prótese, por exemplo), na medicina (ortopedia) e em obras de arte, como monumentos e esculturas (CALLISTER, 2002). A corrosão pode ser definida como a deterioração de um material, geralmente metálico, por ação química ou eletroquímica do meio em que se encontra, aliada ou não a esforços mecânicos (GENTIL, 2011). Considerando-se que essa deterioração provoca alterações indesejáveis no material (como desgaste, variações químicas ou modificações estruturais), fazendo com que seu uso seja considerado inadequado, torna-se imprescindível a utilização de agentes anticorrosivos. Tais inibidores são substâncias orgânicas ou inorgânicas, que quando adicionadas ao meio corrosivo, evitam ou diminuem o desenvolvimento das reações de oxirredução (FRAUCHES-SANTOS, 2014). Tendo em vista que o H2Salen [N,N-(bis-salicilideno)etilenodiamina] é uma Base de Schiff tetradentada, a qual apresenta um grupo funcional hidroxila na posição orto em relação ao grupo azometano, o composto citado possui características químicas significantes para atuar como um futuro agente anticorrosivo. Diante das informações apresentadas anteriormente, o presente trabalho tem como objetivo avaliar o efeito anticorrosivo do H2Salen em um sistema composto por uma peça metálica de liga aço-carbono imersa em uma solução de ácido clorídrico e etanol.
Material e métodos
MATERIAL: - Béqueres; - Peça metálica de liga aço-carbono; - pHmetro; - Balança Analítica. MÉTODOS: A Base de Schiff tetradentada, comumente chamada de H2Salen, foi obtida por reação de 1,0 mL de salicilaldeído com 0,4 mL de etilenodiamina em metanol com aquecimento a 60 ºC e constante agitação. Após seco em estufa e caracterizado por 1H-RMN e CG-MS, foi avaliada a atividade anticorrosiva por potenciometria e condutimetria. Para realização do teste anticorrosivo, utilizaram-se 10 béqueres, cada um contendo 70 mL de ácido clorídrico (HCl) 0,1025 mol/L e 20 mL de etanol P. A. Em 5 desses, imergiu-se uma peça metálica de liga aço-carbono devidamente lixada. Assim foi possível comparar a variação de pH e condutividade elétrica entre soluções com aproximadamente a mesma quantidade da Base de Schiff. As soluções D e D’ foram os brancos, ou seja, continham apenas a solução de HCl e etanol. As soluções representadas por A, B, C e D contêm peça metálica; as representadas por A’, B’, C’ e D’, não. As quantidades de H2Salen adicionadas em cada béquer estão indicadas na tabela a seguir, assim como os valores de pH e condutividade obtidos para cada uma das soluções. Depois de aproximadamente 24 horas de reação, as peças metálicas foram retiradas dos béqueres e verificaram-se o pH e a condutividade elétrica da solução de cada béquer, utilizando-se um pHmetro e um condutivímetro. Tabela 1 - Valores de condutividade e pH obtidos para cada solução. Solução | Massa de H2Salen (mg) | pH (23,5 ± 0,5 ºC) | Condutividade (mS/cm a 25,0 ± 0,5 ºC) A 50,00 1,10 14,47 A’ 50,90 1,10 14,85 B 100,0 1,15 13,72 B’ 100,9 1,13 14,25 C 149,6 1,17 13,11 C’ 151,1 1,16 13,37 D Branco 1,15 14,60 D’ Branco 1,11 15,88
Resultado e discussão
Após imersão da peça metálica na solução de HCl, nota-se que a concentração de
íons hidrônio diminui, enquanto ocorre a corrosão da peça metálica. Essa
variação da concentração de íons hidrônio está relacionada com a condutividade
elétrica e com o pH. A condutividade elétrica de uma solução depende da
quantidade de íons presentes na mesma, já que esses são espécies químicas
eletricamente carregadas. Além disso, depende da mobilidade desses íons. Logo, a
presença de íons hidrônio proporciona uma condutividade elétrica mais elevada.
Por outro lado, o pH (potencial hidrogeniônico) diminui com o aumento da
concentração dos íons hidrônio.
Nas soluções que não continham peça metálica (A’, B’, C’ e D’), não se observa
reações redox, enquanto nas que continham a peça metálica (A, B, C e D),
observa-se a corrosão do ferro metálico em maior quantidade para o recipiente
com ausência da Base de Schiff. A eficácia anticorrosiva do H2Salen
pode ser comprovada verificando que, à medida que esse anticorrosivo é
adicionado nas soluções, diminui a diferença de pH e de condutividade entre as
soluções sem peça metálica e as soluções – de respectiva quantidade de
H2Salen – com peça metálica, obtendo-se uma diferença de 1,28 mS/cm
entre os valores de condutividade dos brancos e 0,26 mS/cm quando utiliza-se 50
mg da Base de Schiff. Como é possível observar nos gráficos anexados:
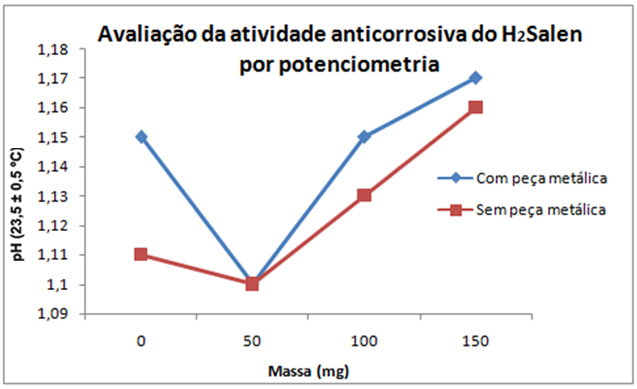
Avaliação da atividade anticorrosiva do H[sub]2[/sub]Salen por potenciometria
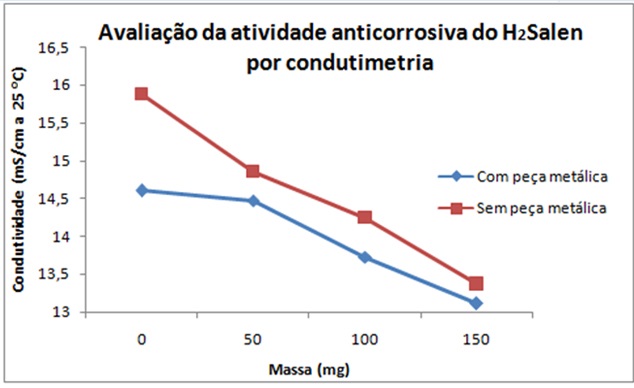
Avaliação da atividade anticorrosiva do H[sub]2[/sub]Salen por condutimetria
Conclusões
Tanto em relação ao pH, quanto em relação à condutividade, observou-se maior diferença entre os valores obtidos pelas soluções com ausência da Base de Schiff. Pode-se confirmar, portanto, a eficácia do efeito anticorrosivo desse composto. Além disso, verificou-se que o anticorrosivo atuou de forma mais eficaz nas soluções que continham aproximadamente 50 mg do mesmo, já que não houve diferença significativa entre os pH’s dessas; o efeito também foi verificado em concentrações superiores do anticorrosivo, sendo destacado nas amostras que continham aproximadamente 150 mg de H2Salen.
Agradecimentos
Primeiramente а Deus; À minha família; Ao professor orientador Wagner Terra; Ao colega de trabalho Luankeen Araújo; À Petrobras e ao IFF Cabo Frio.
Referências
CALLISTER, W. D. Ciência e Engenharia de Materiais: Uma Introdução. 5ª Ed. LTC: Livros Técnicos e Científicos. São Paulo, 2002.
GENTIL, Vicente. Corrosão. 6ª ed. LTC: Livros Técnicos e Científicos. Rio de Janeiro, 2011.
FRAUCHES-SANTOS, C.; Albuquerque, M. A.; Oliveira, M. C. C.; Echevarria, A. A corrosão e os agentes corrosivos. Revista Virtual Química, 2014.










