ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Egito, M.S. (UFPE) ; Silva, T.G. (UFPE) ; Militão, G.C.G. (UFPE) ; Albuquerque, J.F.C. (UFPE)
Resumo
O câncer, doença caracterizada pelo crescimento descontrolado de células malignas, é a maior causa de óbitos no mundo. Um dos maiores problemas em alguns cânceres é a resistência aos fármacos não havendo resposta ao tratamento. As tiazolhidrazonas são conhecidas pelo seu valor terapêutico. Para encontrar uma molécula ativa para células tumorais, nova tiazolhidrazona foi sintetizada em reação de duas etapas: tiossemicarbazida e 4-Clorobenzaldeído, reagindo o produto obtido com Brometo de 4-hidroxiacetofenona. A atividade citotóxica foi avaliada pelo método MTT. O composto apresentou percentual de inibição significativo. A sua estrutura química foi confirmada por métodos espectroscópicos (RMN1H, RMN13C e infravermelho). Suas constantes físicas foram determinadas.
Palavras chaves
leucemia; tiazol; tiazolhidrazona
Introdução
De acordo com a Organização Mundial de saúde, em 2012 foram registrados 14 milhões de casos de câncer. Esta patologia é uma das principais causas de mortes no mundo. Em 2012 foi registrado o total de 8,2 milhões de óbitos. O câncer pode afetar qualquer parte do corpo sendo caracterizado pela transformação de uma célula normal em maligna. Vários fatores podem levar ao surgimento das células neoplásicas, como fatores genéticos, carcinógenos físicos (radiação ultravioleta e ionizante), biológicos (infecções por certos vírus, bactérias e parasitos) e produtos químicos cancerígenos como amianto e arsênico (WHO, 2014). Um dos maiores problemas no tratamento de alguns tipos de câncer é o desenvolvimento, por parte das células tumorais, do fenômeno de resistência aos fármacos utilizados, não havendo resposta ao tratamento. O grande desafio na busca por uma molécula que combata o câncer é a minimização de seus efeitos colaterais atuando apenas nas células malignas, não comprometendo as células saudáveis. Neste contexto, estão inseridas as tiazolhidrazonas. Estas moléculas possuem em suas estruturas dois grupos bioativos, o tiazol e a hidrazona. Com isso, a intenção está voltada para potencializar o efeito biológico destas moléculas por meio de seus efeitos cooperativos (TARASCONI et al., 2000). Os tiazois são compostos heterocíclicos contendo Nitrogênio e Enxofre e duas ligações duplas no anel heterocíclico de cinco membros. Estão presentes em várias moléculas biologicamente ativas. Além disso, são muito utilizadas em várias reações da síntese orgânica (SOUZA et al., 2005). Este núcleo e seus derivados possuem diversas atividades biológicas descritas na literatura, como antibacteriana, antifúngica, anti-inflamatória, anti-hipertensiva, anti-HIV e antitumoral (ZHANG et al., 2012)
Material e métodos
O 4-{2-[N’-(4-Cloro-benzilideno)-hidrazina]-tiazol-4-il}-fenol (Ju-726) foi obtido em duas etapas. Na primeira, ocorreu a reação entre tiossemicarbazida e 4-Clorobenzaldeído, obtendo o derivado tiossemicarbazônico. Na segunda etapa, ocorreu condensação entre a molécula obtida na etapa anterior, 4- Clorotiossemicarbazona, e 2-Bromo-4’-hidroxiacetofenona em ácido clorídrico e iso-propanol (Figura 1). Após 15 minutos de agitação magnética à temperatura ambiente, foi observado formação de precipitado amarelo. Este precipitado foi submetido à cromatografia de camada delgada e verificado o término da reação. Em seguida, o produto foi purificado, pesado, caracterizada a estrutura e submetido ao teste citotóxico. Para determinação desta atividade foram utilizadas células da linhagem HL-60 (leucemia promielocítica humana). A atividade foi avaliada pelo método MTT, baseado na conversão do sal 3-(4,5-dimetil-2-tiazol)-2,5- difenil-2-H-brometo de tetrazolium (MTT) em azul de formazan, a partir de enzimas mitocondriais presentes nas células metabolicamente ativas. As células foram plaqueadas na concentração 3x10 5 células/mL. O Ju-726 foi previamente dissolvido em DMSO e depois diluído em série no meio de cultura para obtenção da concentração final (25 μg/mL). Em seguida, a substância foi distribuída em placa de 96 poços (100 μL/poço). As placas incubadas por 72 horas em estufa a 5% de CO2 a 37 oC. Posteriormente, adicionado 25 μL da solução de MTT (sal de tetrazolium) e as placas incubadas por 3h. No final deste período, o meio de cultura e o excesso de MTT foi aspirado e depois 100 μL de DMSO foi adicionado a cada poço para dissolver os cristais de formazan. A doxorubicina foi utilizada como padrão e a absorbância lida em espectrofotômetro a 595 nm.
Resultado e discussão
Os resultados apresentados pelo 4-{2-[N’-(4-Cloro-benzilideno)-hidrazina]-
tiazol-4-il}-fenol (Ju-726) puro foram: Ponte de Fusão 267-268 ºC e
Rf 0,39 (hexano e acetato de etila na proporção 0,6:0,4). O rendimento foi de 91
%, resultado este considerado muito bom. A reação foi processada em apenas 15
minutos, à temperatura ambiente, não precisando, portanto, levar ao aquecimento.
Isto torna a reação promissora, uma vez que não houve gasto de água nem energia
para a sua realização. A estrutura química da molécula foi confirmada a partir
dos espectros de Ressonância Magnética Nuclear de Hidrogênio e Carbono treze e
do espectro de Infravermelho. Os picos obtidos foram os seguintes: IV,
principais sinais: (ν cm –1, KBr) 3267 (N–H); 3117 (O–H); 1622 (C=N);
1594 (C=C). RMN1H (400 MHz, DMSO-d6, ppm): δ 9,41 (s, 1H,
NH); 8,13 (s, 1H, CH=N), 7,69 (d, 2H, J = 8 Hz, Ar-H); 7,63 (d, 2H, J = 8,2 Hz,
benzilideno); 7,48 (d, 2H, J = 8,2 Hz, benzilideno); 7,08 (s, 1H, H tiazólico);
6,82 (d, 2H, J = 8,8 Hz, Ar-H). RMN13C (100 MHz, ppm, DMSO-
d6): δ 168,05 (S-C=N); 157,56 (HO-C=C); 148,3 (CH=N); 141,87 (CH
benzilideno); 134,03 (C=C-N); 133,03 (C=C-Cl); 129,29 (CH benzilideno); 128,96
(CH benzilideno); 128,16 (CH benzilideno); 128,01 (Cq Ar); 127,27 (CH Ar);
124,41 (Cq benzilideno); 115,44 (CH Ar); 115,05 (CH Ar); 101,26 (S-CH). O
composto sintetizado apresentou atividade anticâncer relevante frente às células
HL-60. Na concentração de 25 µg/mL, apresentou 84,2 % de citotoxicidade. Este
resultado foi considerado promissor, uma vez que este valor é superior ao que
preconiza o protocolo adotado, que considera ativos compostos que inibem 50 % da
proliferação celular em concentrações menor ou igual a 30 µg/mL (GERAN et al.,
1972).
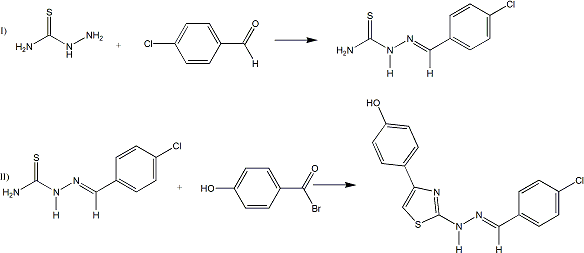
Esquema de síntese da nova tiazolhidrazona. I) Etapa de síntese do derivado tiossemicarbazônico; II)Etapa de formação da tiazolhidrazona.
Conclusões
O composto sintetizado apresentou excelente rendimento. Todas as constantes físicas e espectros foram determinados. As constantes físicas foram taxativas para determinar a pureza do composto. A tiazolhidrazona sintetizada apresentou boa atividade citotóxica frente às células HL- 60, apesar do seu resultado ter sido mais baixo que o demonstrado pelo padrão, foi considerado promissor. O produto reacional foi considerado inédito na literatura. O fato de não gastar água para a sua síntese nem energia elétrica e ser rápida deixa a reação mais barata e viável do ponto de vista ambiental e econômico.
Agradecimentos
Ao CNPq pelo financiamento da pesquisa.
Referências
GERAN, R.I., GREENBERG, N.H, MACDONALD, M.M., SCHUMACHER, A.M., ABBOTT, B.J. Protocols for screening chemical agents and natural products against animal tumors and other biological systems. Cancer Chemother Rep, v.3, p.1-103, 1972.
SOUZA, M.V.N., FERREIRA, S.B., MENDONÇA, J.S., COSTA, M., REBELLO, F. Métodos de obtenção e aplicações sintéticas de tiazóis, uma importante classe de compostos heterocíclicos. Química Nova; v.28, n.1, p.77-84, 2005.
TARASCONI, P.; CAPACCHI, S.; PELOSI, G.; CORNIA, M., ALBERTINI, R., BONATI, A., DALL’AGLIO, P.P., LUNGHI, P., PINELLI, S. Synthesis, Spectroscopic Characterization and Biological Properties of New Natural Aldehydes Thiosemicarbazones. Bioorganic & Medicinal Chemistry; v. 8, n. 1, p. 157-162, 2000.
ZHANG, D.N., LI, J.T., SONG, Y.L., LIU, H.M., LI, H.Y. Efficient one-pot three-component synthesis of N-(4-arylthiazol-2-yl) hydrazones in water under ultrasound irradiation. Ultrasonics Sonochemistry; v.19, p.475-478, 2012.
WORLD HEALTH ORGANIZATION (WHO). Media centre–Cancer. Fact sheet N°297 - Fevereiro 2014. www.who.int/mediacentre/factsheets/fs297/en/. Acessado no dia 25/07/2014.










