ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Batista, P.R. (UTFPR) ; Guerrero, P.G. (UTFPR) ; Vidal, L.N. (UTFPR) ; de Oliveira, P.R. (UTFPR)
Resumo
Ciclohexanos 1,3-dissubstituídos são modelos muito interessantes para o estudo de ligações de hidrogênios inter e intramoleculares, importantes na determinação de diversas estruturas tridimensionais simples ou complexas como proteínas, DNA e RNA. Cálculos teóricos DFT em nível M06-2X/6-311++G(3df,3pd) mostraram que a substituição do hidrogênio por um grupo metil no nitrogênio em aminociclohexanóis cis-1,3-dissubstituídos, promove o aumento da força da ligação de hidrogênio intramolecular O-H•••N por efeitos indutivos, superando os efeitos estéricos que também se intensificam. Em ambos os equilíbrios a conformação diaxial predomina sobre a diequatorial. A formação da ligação de hidrogênio foi confirmada pelas análises topológicas QTAIM, NCI e por estudos de NBO.
Palavras chaves
Ligação de Hidrogênio; QTAIM; NBO
Introdução
A estereoquímica é uma área de estudo da química que descreve como os átomos das moléculas estão arranjados no espaço tridimensional. Cada arranjo de uma molécula caracteriza uma conformação e as características conformacionais podem influenciar na reatividade desta molécula, favorecendo um produto específico (CAREY e SUNDBERG, 2007). A ligação de hidrogênio intramolecular (LHI) é um tipo de interação que exerce grande influência na preferência conformacional em sistemas moleculares (KARPLUS et al., 2013), algumas vezes mais do que os efeitos estéricos. Muitos trabalhos estudam os efeitos das ligações de hidrogênio nas estruturas moleculares, de proteínas e ácidos nucléicos, pois tal interação é um dos fatores responsáveis em predizer os desdobramentos de complexos biológicos (CORMANICH et al., 2013, DUARTE et al., 2013). O entendimento das interações inter e intramoleculares é de grande importância para estudos de equilíbrios conformacionais de ciclohexanos cis-1,3- dissubstituídos, porque avalia a competitividade entre o efeito repulsivo 1,3- diaxial e o efeito estabilizador das LHI nos confôrmeros diaxiais. Estas análises ajudam a entender as estruturas das grandes moléculas, como por exemplo, as proteínas que possuem várias ligações de hidrogênio intramoleculares (OLIVEIRA e RITTNER, 2008). Portanto o principal objetivo deste trabalho foi estudar o efeito da LHI O-H•••N nos equilíbrios conformacionais do isômero cis do 3-aminociclohexanol (ACOH) e do 3-N-metilaminociclohexanol (MACOH) e observar a influência do efeito estérico 1,3-diaxial com o aumento do volume do substituinte nestes equilíbrios.
Material e métodos
Os aminocicloexanois cis-1,3-dissubstituídos foram estudados através de cálculos teóricos na teoria do funcional de densidade (DFT) e com o nível M06-2X/6- 311++G(3df, 3pd) (ZHAO e TRUHLAR, 2008) utilizando o Gaussian09 (FRISCH et al., 2009). Os rotâmeros diaxiais (aa) e diequatoriais (ee) tiveram suas geometrias otimizadas para a obtenção das frequências e energias do estado fundamental com a correção do ponto zero. As propriedades termodinâmicas foram obtidas utilizando o programa de análise termodinâmica estatística Gibbs01 (COSTA, 2013). As interações hiperconjugativas e repulsivas foram obtidas através da análise de orbitais naturais ligantes (NBO 6.0). As análises topológicas QTAIM e NCI foram realizadas utilizando os softwares AIMALL (KEITH, 2009) e NCIPLOT (GARCÍA et al., 2011) respectivamente.
Resultado e discussão
O ACOH e o MACOH apresentaram a conformação aa como a mais estável. As energias
de Gibbs (∆G) para os equilíbrios foram de 0,93 kcal.mol-1 e 1,52 kcal.mol-1
para o ACOH e MACOH respectivamente, sendo a interconversão da conformação aa
para a ee, em ambos os casos, não espontânea. As proporções da conformação aa
foram de 83% no ACOH e de 93% no MACOH em relação a conformação ee. A análise
topológica QTAIM identificou a LHI O17-H18•••N19 nas duas conformações aa
(Figura 1a e 1a’) com a presença de Caminho de Ligação, Ponto Crítico de Ligação
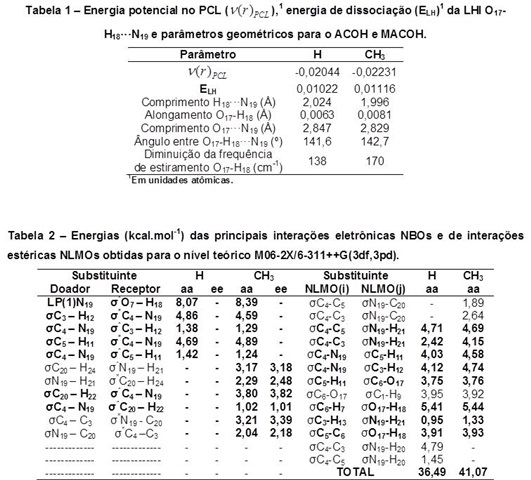
e Ponto Crítico de Anel. As energias de dissociação (ELH) da LHI O17-H18•••N19
apresentadas na Tabela 1 mostram que a força da ligação de hidrogênio é maior no
MACOH (0,01116 u.a.) do que no ACOH (0,01022 u.a.) (ESPINOSA, MOLINS e LECOMTE,
1998). A isosuperfície de cor azul (Figura 1b e 1b’) e a análise topológica NCI
(Figura 1c e 1c’) confirmam a presença da LHI O17-H18•••N19 tanto no ACOH quanto
no MACOH. Todos os parâmetros geométricos (Tabela 1) também mostraram que a
força da LHI aumenta no MACOH. O estudo de NBO (Tabela 2) revelou interações de
transferência eletrônica para o nitrogênio por efeito indutivo, com algumas
apresentando energias maiores que 3 kcal.mol-1. O grupo metil favorece o efeito
indutivo com doação de densidade eletrônica para o nitrogênio, observado pelas
interações σC20–H22-> σ*C4–N19 e σC4–N19-> σ*C20–H22 do MACOH. Estas interações
ajudam a explicar porque a LHI é mais forte para MACOH do que para ACOH. A soma
das principais interações estéricas entre NLMO’s (Tabela 2) resultaram em 36,49
kcal.mol-1 para o ACOH e de 41,07 kcal.mol-1 para o MACOH, resultando no aumento
dos efeitos estéricos devido à mudança de um hidrogênio para uma metila no grupo
amino.

Conclusões
Os aminociclohexanóis cis-1,3-dissubstituídos apresentaram a conformação aa como sendo a mais estável no equilíbrio conformacional, devido à formação da LHI O- H•••N. A substituição do hidrogênio por um grupo metil no átomo de nitrogênio fez com que a força da LHI aumentasse, elevando a proporção da conformação aa do MACOH em 10,0% em relação ao ACOH. Isto ocorre porque os efeitos indutivos aumentam, superando os efeitos estéricos que também se intensificam.
Agradecimentos
LFQO-UNICAMP, LQT-UTFPR, Fundação Araucária e CENAPAD-SP
Referências
CAREY, F. A.; SUNDBERG, R. J. Advanced organic chemistry. 5. ed. New York: Springer, 2007.
CORMANICH, R. A.; DUCATI, L. C.; TORMENA, C. F.; RITTNER, R. A theoretical investigation of the dictating forces in small amino acid conformational preferences: The case of glycine, sarcosine and N,N-dimethylglycine. Chemical Physics, v. 421, p. 32-38, 2013.
COSTA, G. J. Estudo espectroscópico e termodinâmico do equilíbrio conformacional do metanoato de cis-3-hidroxi-cicloexila. 2013. 22 f. Relatório de estágio supervisionado – Departamento Acadêmico de Química e Biologia, Universidade Tecnológica Federal do Paraná, 2013.
ESPINOSA, E.; ALKORTA, I.; ROZAS, I.; ELGUERO, J.; MOLINS, E. About the Evaluation of the Local Kinectic, Potencial and Total Energy Density in Closed-Shell Interactions. Chemical Physical Letters, v. 336, p. 457-461, 2001.
FRISCH, M. J.; TRUCKS, G. W.; SCHLEGEL, H. B.; SCUSERIA, G. E.; ROBB, M. A.; CHEESEMAN, J. R.; SCALMANI, G.; BARONE, V.; MENNUCCI, B.; PETERSSON, G. A.; NAKATSUJI, H.; CARICATO, M.; LI, X.; HRATCHIAN, H. P.; IZMAYLOV, A. F.; BLOINO, J.; ZHENG, G.; SONNENBERG, J. L.; HADA, M.; EHARA, M.; TOYOTA, K.; FUKUDA, R.; HASEGAWA, J.; ISHIDA, M.; NAKAJIMA, T.; HONDA, Y.; KITAO, O.; NAKAI, H.; VREVEN, T.; MONTGOMERY, JR., J. A.; PERALTA, J. E.; OGLIARO, F.; BEARPARK, M.; HEYD, J. J.; BROTHERS, E.; KUDIN, K. N.; STAROVEROV, V. N.; KOBAYASHI, R.; NORMAND, J.; RAGHAVACHARI, K.; RENDELL, A.; BURANT, J. C.; IYENGAR, S. S.; TOMASI, J.; COSSI, M.; REGA, N.; MILLAM, J. M.; KLENE, M.; KNOX, J. E.; CROSS, J. B.; BAKKEN, V.; ADAMO, C.; JARAMILLO, J.; GOMPERTS, R.; STRATMANN, R. E.; YAZYEV, O.; AUSTIN, A. J.; CAMMI, R.; POMELLI, C.; OCHTERSKI, J. W.; MARTIN, R. L.; MOROKUMA, K.; ZAKRZEWSKI, V. G.; VOTH, G. A.; SALVADOR, P.; DANNENBERG, J. J.; DAPPRICH, S.; DANIELS, A. D.; FARKAS, Ö.; FORESMAN, J. B.; ORTIZ, J. V.; CIOSLOWSKI, J.; FOX, D. J. Gaussian 09, Revision A.1. Gaussian, Inc., Wallingford CT, 2009.
GARCÍA, C. J.; JOHNSON, R. E.; KEINAN, S.; CHAUDRET, R.; PIQUEMAL, J.; BERATN, N. D.; YANG, W. NCIPLOT: A Program for Plotting Noncovalent Interaction Regions. Journal of Chemical Theory and Computational, v. 7, p. 625-632, 2011.
KARPLUS, M.; LEVITT, M.; WARSHEL, A. Development of multiscale models for complex chemical systems. Scientific Background on the Nobel Prize in Chemistry 2013. Disponível em: <http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2013/advanced.html>. Acesso em: 02 fev. 2014.
KEITH, T. A. AIMAll (Version 12.05.09 Professional). Overland Park: TK Gristmill Software, 2009.
OLIVEIRA, P. R.; RITTNER, R. The subtle electronic effects of alkyl groups on the conformational equilibria and intramolecular hydrogen-bond strength in cis-3-alkoxycyclohexanols. Spectrochimica Acta Part A, v. 70, p. 1079-1086, 2008.
ZHAO, Y.; TRUHLAR, D. G. The M06 Suite of Density Functionals for Main Group Thermochemistry, Thermochemical Kinetics, Noncovalent Interactions, Excited States, and Transition Elements: Two New Functionals and Systematic Testing of Four M06-Class Functionals and 12 Other Functionals. Theor. Chem. Account, v. 120, p. 215-241, 2008.










