ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Souza Cavalcante, N.G. (UFRN) ; Queiroz Duarte Medina, A.C. (UFRN) ; de Lima Pontes, D. (UFRN) ; Facundo de Brito, A.C. (UFRN)
Resumo
A quitosana purificada na forma de acetato apresentou massa molar de 4,1x104g/mol e grau de desacetilação de 52,1%. A formação da base de Schiff a partir da quitosana e da orto-vanilina pode ser comprovada através da banda em 1634 cm-1 atribuída à vibração C=N características de iminas, não sendo observada para a QT. Já a espectroscopia na região do UV-Vis mostra o deslocamento da banda de 341nm da OV para 336 nm na BS indica mudança no ambiente químico, confirmando a formação da BS através da formação da ligação C=N. A presença do metal é confirmada pelas bandas d-d em 647 nm e 703 nm.
Palavras chaves
Quitosana; Base de Schiff; Níquel
Introdução
A quitosana (QT) é um polissacarídeo de cadeia linear, catiônico, que ocorre naturalmente ou pode ser obtido por desacetilação da quitina (SANTOS et al, p. 242-249, 2003). Apresenta grupos funcionais potencialmente reativos: grupos amino (-NH2), além de vários grupos hidroxilas primários e secundários nas posições C-2, C-3 e C-6, respectivamente, que apresentam forte afinidade com a água (PETER, p. 629, 1995). As modificações nestes grupos produzem diferentes materiais que podem ter diversas aplicações. Dentre as modificações que a QT pode sofrer, a formação da base de Schiff (BS) tem chamado bastante atenção por parte dos pesquisadores, tendo em vista sua diversidade de aplicações como atividade biológica, dentre elas antibacteriana (SARI et al, p. 283- 288,2003),antifúngica (ECHEVARRIA et al, p. 60, 1999), antimicrobiana (SAKYAN et al, p. 115-120, 2004), anti HIV (PANDEYA et al, p. 11-17, 1999) e atividade antitumoral (DIMMOCK, 1997). As BS apresentam um papel importante na química de coordenação, pois formam complexos estáveis com vários metais de transição. Diante do exposto, o objetivo do trabalho é obter BS biopolimérica a partir da QT e orto-vanilina (OV), que é um aldeído aromático com um grupo hidroxila no carbono 2 e um metoxi no carbono 3 do anel benzênico, com posterior incorporação de metais de transição para a formação de complexos estáveis.
Material e métodos
A QT utilizada foi purificada a fim de garantir a reprodutibilidade dos resultados. O método de purificação na forma acetato foi realizado na seguinte forma: a QT comercial é solubilizada em ácido acético e posteriormente, é acrescentado acetato de sódio à solução que permanece sob agitação por 24 h. Ao final da agitação, a solução é filtrada e a QT é precipitada em etanol sendo então filtrada novamente para obtenção do polímero purificado. Para a síntese da BS, a QT purificada foi solubilizada em uma mistura de solvente ácido acético e metanol em um balão de fundo redondo, ajustou-se o pH para 4 e foi deixado sob agitação por 24 h. Após o período de agitação, a OV solubilizada em metanol foi adicionada ao balão. O pH foi ajustado para 5 e o sistema ficou sob agitação lenta por mais 24 h, seguida de filtração e secagem. Após a formação da BS ocorreu a incorporação do centro metálico (Níquel), para tanto a BS foi solubilizada em metanol e em seguida adicionado uma solução de cloreto de níquel em metanol e deixou-se sob agitação por 15 h, em seguida o material foi filtrado e seco.
Resultado e discussão
A QT purificada na forma de acetato apresentou grau de desacetilação de 52,1% e
massa molar viscosimétrica de 4,1 x 104 g/mol. A reação de modificação da QT
para a formação da BS foi resultado da adição nucleofílica do grupamento NH2 da
Quitosana ao carbono carbonílico da orto-vanilina, resultando em um grupo
imina(-CH=N-). A modificação pode ser comprovada através da comparação entre os
espectros de Infravermelho da QT e BS originada. As principais bandas observadas
para a QT foram: estiramento axial de OH em 3442 cm-1, a qual aparece sobreposta
à banda de estiramento de N-H; deformação axial de C=O de amida I em 1652 cm-1;
deformação angular de N-H de amina primária em 1564 cm-1; estiramento C-O de
álcool primário em 1022 cm-1. Para a BS observa-se uma banda em 1634 cm-1
atribuída à vibração C=N características de iminas (GUINESI et al, p. 557,
2006), não sendo observada para a QT. Por outro lado, também não há evidências
de bandas características de aldeídos aromáticos livres próximo de 1665 cm-1, ou
seja, aparentemente não existe orto-vanilina livre na BS.
Para uma maior comprovação da síntese da BS, foram feitas análises comparativas
entre a OV e BS a partir do Uv-Vis. Desse modo, o espectro da OV apresenta
bandas em 266 e 341 nm. Já em relação à BS observam-se bandas em 268 nm e 336
nm. O deslocamento da banda de 341 da OV para 336 nm na BS indica mudança no
ambiente químico, confirmando a formação da BS através da formação da ligação
C=N. A formação do complexo e a presença do níquel na estrutura são comprovadas
a partir das bandas d-d em 647 nm e 703 nm, devido às duas possibilidades de
transição eletrônica t2g → eg* de acordo com a TOM.
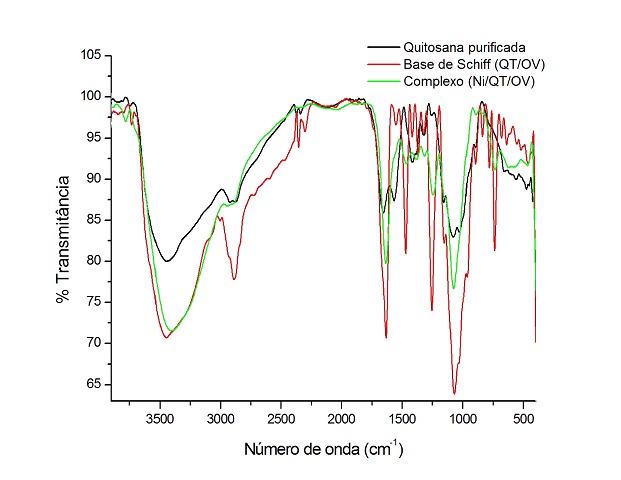
Sobreposição dos espectros da QT, BS e complexo na região de 4000 a 400 cm-1.
Conclusões
A QT purificada da forma acetato possui massa molar de 4,1x104g/mol e grau de desacetilação de 52,1%. Os resultados de espectroscopia na região do Infravermelho e Uv-Vis indicam a formação de uma BS a partir da reação da QT com a OV. A inserção de níquel à BS foi comprovada através de Uv-Vis por meio das bandas d-d 647 e 703 nm e dos deslocamentos das bandas apresentados entre os espectros de Infravermelho BS e do complexo.
Agradecimentos
Os autores agradecem à Capes, UFRN e ao LQCPol pelos recursos que possibilitaram a realização dessa pesquisa.
Referências
1Santos, J. E.; Soares, J. P.; Dockal, E. R.; Cavalheiro, E. T. G.; Filho, S. P. C. Polímeros: Ciência e Tecnologia. 2003, 13, 242-249.
2Peter, M. G. J. Macromol. Sci-Pure e Appl. Chem., 1995, 629.
3Echevarria, A.; Nascimento, M. G.; Gerônimo, V.; Miller, J. e Giesbrecht, A., J. Braz. Chem. Soc. 1999, 10, 60.
4Sakyan, I.; Logoglu, E.; Arslan, S.; Sari, N. e Akiyan, N. Biometals. 2004, 115–120.
5Pandeya, S. N.; Sriram, D.; Nath, G. e Clercq. E.Pharmaceutica Acta Helvetiae. 1999, 74, 11-17.
6Dimmock, J. R., Curr. Med. Chem. 1997.
7Guinesi, L. S., Cavalheiro, É. T. G. Carbohydrate Polumers. 2006, 65, 557.










