ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Costa, G.M.P. (UFPA) ; Santos, A.S. (UFPA) ; Souza, M.G.S. (UFPA) ; Souza, M.G.S. (UFPA)
Resumo
As enzimas ligninolíticas peroxidases e fenoloxidases degradam a lignina, um composto aromático. Baseado nesta característica podem ser empregadas no tratamento de efluentes industriais e na biorremediação de xenobióticos. Utilizou-se o corante azóico Remazol Brilliant Blue R como indicador de tais enzimas. Das quais 21 linhagens ensaiadas, somente uma conseguir deteriorar o RBBR. Os meios de cultura sólidos testados consisti no Ágar extrato de malte (EMA), Meio para lacase (MPL), Ágar czapeck (CZ) e Ágar glicose extrato de levedura peptona (GPY), verificando o tempo de crescimento e descoramento. Os resultados positivos foram observados no EMA e MPL 72 horas de cultivo e CZ no quarto dia. O fungo se desenvolveu no meio GPY, porém não ocorreu a degradação do corante.
Palavras chaves
RBBR; PEROXIDASES; FENOLOXIDASES
Introdução
Os fenômenos associados à industrialização, revolução agrícola e expansão demográfica observados nas últimas décadas do século XX impuseram, em decorrência de todas as implicações ambientais associadas e suas consequências cada vez mais evidentes, a necessidade de manejo e tratamento dos resíduos gerados e por vezes acumulados em diferentes compartimentos da biosfera (HENN, 2009). Uma das alternativas para o tratamento dos resíduos químicos e ambientes contaminados é a biorremediação, onde se podem utilizar microrganismos produtores de enzimas ligninolíticas para a biodegradação de compostos tóxicos. Estas são originadas, em grande parte, pelos grupos Ascomycetes, Deuteromycetes e Basidiomycetes (AZEVEDO & ESPOSITO, 2010). A habilidade de oxidar compostos fenólicos tem sido utilizada como critério para identificação de fungos da degradação branca verdadeiros. As principais são as peroxidases, caracterizada como lignina-peroxidase uma glicoproteína que contém ferroprotoporfirina IX (heme) como grupo prostético e requer peróxido de hidrogênio para a atividade e Mn-peroxidase é ativada com H2O2 e o íon Mn+2, fenoloxidases denominada de lacase uma cuproproteína que reduz quatro elétrons de oxigênio a água (TAVARES, 2006). A busca por fungos lignolíticos está relacionada à capacidade de tolerar altas concentrações de poluentes tóxicos. Isso ocorrer por causa da habilidade de degradar a lignina. Selecionar microrganismos das sementes de Carapa guianensis (andiroba) e Manihot suculenta (mandioca) que tenham o potencial de produzir enzimas ligninolíticas. Pode ser aproveitado para futuros estudos na biorremediação das áreas contaminadas da região Amazônica ou do país, como em derramamentos acidentais de hidrocarbonetos benzeno, tolueno, etilbenzeno e xilenos (BTEX).
Material e métodos
LOCAL Os ensaios foram realizados nos Laboratórios de Investigação Sistemática em Biotecnologia e Biodiversidade Molecular (LabISisBio) situado na Universidade Federal do Pará (UFPA), em Belém, PA. OBTENÇÃO DOS MICRORGANISMOS Utilizou-se 21 isolados fúngicos na, adquiridos da Micoteca do grupo de pesquisa LabISisBio, sendo estes isolados das sementes de mandioca e da andiroba. Codificados de MIBA, microrganismos de interesse biotecnológico da Amazônia. Semeados em meio de cultura ágar batata dextrose, meio de manutenção dos microrganismos e armazenados a temperatura ambiente. TESTE ENZIMÁTICO Lacase (NIEBISCH, 2009) O meio de cultura para determinar a atividade lacasica foi ensaio utilizando o corante Remazol Brilliant Blue R (RBBR) nos seguintes meios: EMA (Extrato de malte ágar): 1% (m/v) extrato de malte, 0,5% RBBR e 2% ágar. MPL (Meio para lacase): 1% extrato de malte, 0,1% Tween 80, 0,0005% CuSO4.5H2O, 0,5% RBBR e 2% ágar. GPY (Glicose peptona extrato de levedura): 1% glicose, 0,25% peptona, 0,25% extrato de levedura, 0,5% RBBR e 2% ágar. CZ (Czapek): 1% sacarose, 0,2% NaNO3, 0,05% MgSO4, 0,05% KCl, 0,001% FeSO4, 0,1% KH2PO4, 0,5% RBBR e 2% ágar. Feitos em duplicata com e sem corante Remazol Brilliant Blue R (RBBR), autoclavados a 121°C a 1atm por 15 minutos. Dispensados em placas de Petri. A fim de selecionar os potencialmente produtores das enzimas peroxidases e fenoloxidases. Incubados a temperatura ambiente. Nos meios sem corante fez-se o eixo ortogonal de crescimento do micélio que foi medido até atingir o diâmetro da placa (9 cm). Verificando o tempo de descoloração do corante pelo fungo, se o mesmo for positivo para a enzima, formará um halo em torno da colônia de cor alaranjada em contraste ao azul do corante.
Resultado e discussão
Na seleção de peroxidases e fenoloxidases, obteve-se um positivo em 21
microrganismos testados. O corante azóico empregado para o ensaio foi o RBBR
que contém em torno de 4% de cobre no complexo segundo informações técnicas da
empresa DYSTAR, como fonte de nitrogênio no meio de cultura. Todos os fungos
utilizados na avaliação cresceram com o RBBR na concentração de 0,5 %, porém na
triagem o MIBA-0009 foi o único a degradar o corante.
O tempo em que se observou a mudança da tonalidade azul do RBBR a coloração
alaranjada como na fig. 1 se iniciou no terceiro dia nos meios EMA e MPL. No CZ
no período de 96 horas após a inoculação, mas não houver descoloração no GPY
apesar disso o fungo se desenvolveu. Com base nestes dados pode-se afirmar que
o crescimento não está diretamente atrelado à atividade descorante, entretanto o
mesmo não é o da produção das enzimas, pois o RBBR é um indicador. De forma
semelhante, Niebisch (2009) deduziu que o crescimento do micélio não tem relação
com o descoramento ao analisar a Biodegradação do corante têxtil Remazol Azul
por Lentinus crinitus, Lepista sordida e Hydnopolyporus fimbriatus. A fonte de
carbono utilizada no GPY, glicose, influenciou na determinação de fenoloxidases,
pois de acordo com estudos comparativos de Galhaup et al. (2002) a glicose é um
repressor da lacase (uma fenoloxidase) e, quando empregada, a formação de
lacases somente tem início quando diminui a concentração de açúcar no meio.
Na fig. 2 o descoramento menor do meio de cultura para lacase (MPL) está
relacionado à temperatura do ambiente (região norte do Brasil) com variação de
30°C a 34°C a temperatura máxima e 20°C e 24°C a mínima (CPTEC/INPE- INMET/MAPA)
de acordo com Brijwani et al. (2010) em temperaturas superiores a 30°C a
atividade enzimática diminui.
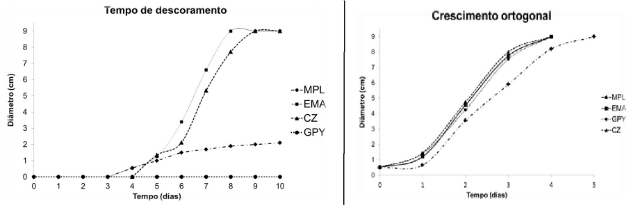
Fig. 2 Tempo de desenvolvimento e descoramento do MIBA-0009 nos meios MPL, EMA, GPY e CZ.
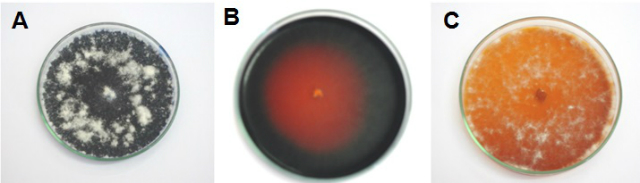
A degradação do corante Remazol Brilliant Blue R: A_GPY, B_MPL e C_EMA. Apresentou o indicativo de enzimas ligninolíticas em MPL, EMA e CZ.
Conclusões
Os resultados obtidos com a degradação do RBBR pelo MIBA-0009 são promissores para a produção e purificação das enzimas ligninolíticas em cultivo submerso, porque a ação destas sugere uma potencial aplicação biotecnológica. Como no aspecto ambiental, na utilização dos fungos lignolíticos na biorremediação de xenobiótico. Das enzimas purificadas no tratamento e remoção de contaminantes, exemplo nas estações de tratamento de indústrias (corantes).
Agradecimentos
Este trabalho foi financiado pela CAPES, CNPQ e PIBIC/UFPA. Ao apoio técnico do grupo de pesquisa LabIsisBio.
Referências
AZEVEDO, J. L. de; ESPOSITO, E. Fungos: uma introdução à biologia, bioquímica e biotecnologia. 2. ed. Caxias do Sul: Educs, 2010. 215-259 p.
BRIJWANI, K.; RIGDON, A.; VADLANI, P. V. Fungal Laccases: production, function and applications in food processing. Enzyme Research. 1-10 p. 2010.
CPTEC/INPE- INMET/MAPA. Infoclima: boletim de informações climáticas. Ano 13. n. 9, INPE: 2006, 9 p.
GALHAUP, C.; HALTRICH, D. Enhanced formation of laccase activity by the white-rot fungus Trametes pubescens in the presence of copper. Applied Microbial Biotechnology, 56: 225-232 p. 2001.
GARCIA, T. A. Purificação e caracterização das lacases de Pycnoporus sanguineus. 2006. 126 p. Tese (Doutorado em Biologia Molecular) – Departamento de Biologia Molecular, Universidade Federal de Brasília, Brasília.
HENN, C. Seleção de linhagens de basidiomicetos resistentes aos herbicidas atrazina e diurom – produção de enzimas ligninolíticas e degradação dos compostos. 2009. 117 p. Dissertação (Mestrado em microbiologia) - Universidade Estadual Paulista, São José do Rio Preto-SP. 2009.
NIEBISCH, C. H. Biodegradação do corante têxtil remazol azul por Lentinus crinitus, Lepista sordida e Hydnopolyporus fimbriatus. 2009. 109 p. Dissertação (Mestrado em Bioquímica e Biologia Molecular) – Universidade Federal do Paraná, Curitiba. 2009.
TAVARES, A. P. M. Produção de lacase para potencial aplicação como oxidante na indústria papeleira. 2006. 190 p. Tese (Doutorado em Engenharia química) – Universidade de Aveiro, Aveiro. 2006.










