ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Machado, C.M.B. (UFPE) ; Lima, N.B. (UFPE) ; Moura, G.L.C. (UFPE)
Resumo
Neste trabalho empregamos cálculos computacionais da densidade de carga eletrônica de átomos pertencentes à estruturas de complexos de ligação de hidrogênio envolvendo a 1,10 fenantrolina, como molécula aceitadora de próton ácido, e diferentes ácidos carboxílicos (RCOOH, R= -H, -CH3 e –C6H5). Utilizamos neste processo várias metodologias computacionais a partir da utilização do programa GAUSSIAN 2009. Nossos resultados mostraram que independente do método computacional escolhido para os três complexos de ligação de hidrogênio estudados houve transferência de densidade de carga eletrônica no sentido da 1,10 fenantrolina →ácidos carboxílicos (RCOOH, R= -H, -CH3 e –C6H5).
Palavras chaves
Transferência de carga; métodos DFT; Ligação de hidrogênio
Introdução
Cálculos ab initio de orbitais moleculares vêm sendo utilizados com sucesso na previsão teórica de propriedades moleculares de complexos de ligação de hidrogênio (LIMA et al, 2012). Esta interação é importante por estar diretamente relacionada com várias propriedades, como por exemplo: estabilidade energética, propriedades estruturais, propriedades espectroscópicas e etc. Neste trabalho temos como objetivo a previsão computacional da densidade de carga eletrônica de átomos pertencentes a estruturas de complexos de ligação de hidrogênio envolvendo a 1,10 fenantrolina, como molécula aceitadora de próton ácido, e diferentes ácidos carboxílicos (RCOOH, R= -H, -CH3 e –C6H5).
Material e métodos
As otimizações das geometrias das moléculas não complexadas e dos complexos de ligação de hidrogênio foram realizadas no programa GAUSSIAN 09 (FRISCH et al, 2009), utilizando-se o método DFT B3LYP (BECKE, 1993) com o conjunto de funções de base 6-31++G(d,p). A partir das geometrias otimizadas, foi realizado o estudo de transferência de densidade de carga eletrônica pelos métodos: NBO (Natural Bond Orbital) ( BRENEMAN, 1990) e CHELPG (Charges from Electrostatic Grid Based-ESP) (REED et. al. 1988), com dois métodos DFT (B3LYP e PBE0) e com o método Moller- Plesset de Perturbação de Segunda Ordem de (MP2), utilizando sempre o conjunto de base 6-31++G(d,p).
Resultado e discussão
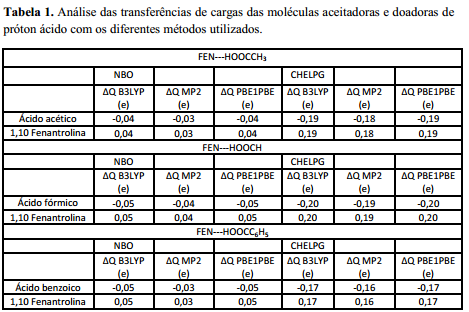
Na tabela 1 apresentamos os valores de densidade eletrônica tanto da molécula
aceitadora de hidrogênio ácido (1,10-fenantrolina) quanto dos ácidos
carboxílicos, os quais agiram como moléculas doadoras de próton ácido. É
importante lembrar que, por serem calculadas por diferentes métodos, não há um
significado na comparação dos valores absolutos das cargas obtidas. Para os
três complexos de ligação de hidrogênio estudados, figura 1, houve transferência
de densidade de carga eletrônica no sentido da 1,10-fenantrolina para os ácidos
carboxílicos (RCOOH, R= -H, -CH3 e –C6H5). A transferência de carga é
resultante do processo de formação da ligação de hidrogênio nestes sistemas,
sendo importante enfatizar que, neste processo, o par de elétrons isolado de um
dos nitrogênios da fenantrolina interage com o hidrogênio ácido.
Ao analisar o efeito da formação da ligação de hidrogênio em relação à densidade
de carga eletrônica dos átomos presentes na estrutura dos complexos, verificamos
que as densidades de carga nos átomos diretamente envolvidos na ligação de
hidrogênio são os mais afetados pela interação. Por exemplo, pelo método NBO os
átomos de hidrogênio ficam mais positivos devido à complexação. No entanto, há o
ganho de carga, ainda que pequeno, para os átomos de oxigênio pertencentes ao
grupo O-H. Também observamos que há ganho de carga pelo átomo de nitrogênio
diretamente envolvido na interação. Pelo método CHELPG, os resultados são
semelhantes aos obtidos pelo método NBO.
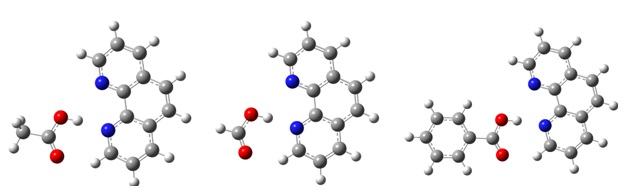
Geometrias otimizadas dos complexos de ligação de hidrogênio.
Conclusões
Neste trabalho realizamos cálculos computacionais dos valores de densidade de carga eletrônica de átomos de complexos de ligação de hidrogênio. Nossos resultados mostraram que, independente do método computacional escolhido para os três complexos de ligação de hidrogênio estudados, houve transferência de densidade de carga eletrônica no sentido da 1,10 fenantrolina →ácidos carboxílicos (RCOOH, R= -H, -CH3 e –C6H5).
Agradecimentos
Os autores agradecem à FACEPE, ao CNPq, à PROPESQ/UFPE e ao PRONEX/FACEPE.
Referências
LIMA, N. B. D., RAMOS, M. N., A Theoretical Study Of The Molecular Structures And Vibrational Spectra Of The N2O(HF)2. Journal Of Molecular Structure, V. 1008, P. 29-34, 2012.
M. J. FRISCH, G. W. TRUCKS, H. B. SCHLEGEL, G. E. SCUSERIA, M. A. ROBB, J. R. CHEESEMAN, G. SCALMANI, V. BARONE, B. MENNUCCI, G. A. PETERSSON, H. NAKATSUJI, M. CARICATO, X. LI, H. P. HRATCHIAN, A. F. IZMAYLOV, J. BLOINO, G. ZHENG, J. L. SONNENBERG, M. HADA, M. EHARA, K. TOYOTA, R. FUKUDA, J. HASEGAWA, M. ISHIDA, T. NAKAJIMA, Y. HONDA, O. KITAO, H. NAKAI, T. VREVEN, J. A. MONTGOMERY, JR., J. E. PERALTA, F. OGLIARO, M. BEARPARK, J. J. HEYD, E. BROTHERS, K. N. KUDIN, V. N. STAROVEROV, R. KOBAYASHI, J. NORMAND, K. RAGHAVACHARI, A. RENDELL, J. C. BURANT, S. S. IYENGAR, J. TOMASI, M. COSSI, N. REGA, J. M. MILLAM, M. KLENE, J. E. KNOX, J. B. CROSS, V. BAKKEN, C. ADAMO, J. JARAMILLO, R. GOMPERTS, R. E. STRATMANN, O. YAZYEV, A. J. AUSTIN, R. CAMMI, C. POMELLI, J. W. OCHTERSKI, R. L. MARTIN, K. MOROKUMA, V. G. ZAKRZEWSKI, G. A. VOTH, P. SALVADOR, J. J. DANNENBERG, S. DAPPRICH, A. D. DANIELS, Ö. FARKAS, J. B. FORESMAN, J. V. ORTIZ, J. CIOSLOWSKI, and D. J. FOX, Gaussian 09, Revision D.01. Gaussian, Inc., Wallingford CT, 2009.
A.D. BECKE, Density‐functional thermochemistry. III. The role of exact Exchange. The Journal of Chemical Physics, Vol. 98, P. 5648, 1993.
BRENEMAN, C. M.; WIBERG, K. B. J. Comput. Chem. Vol. 11, p. 361, 1990.
REED, A. E.; CURTISS, L. A.; WEINHOLD, F. Chem. Rev. Vol 88, p. 899, 1988.










