ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Silva, I.M. (UFPE/FABEJA) ; Lima, B.S.C. (UFPE) ; Sena, K.X.F.R. (UFPE) ; Albuquerque, J.F.C. (UFPE)
Resumo
A diversidade de doenças, os efeitos indesejados dos fármacos e a resistência microbiológica, são alguns dos motivos para pesquisa de novos compostos potencialmente ativos. Nessa perspectiva, um novo derivado tiazolidínico foi sintetizado visando sua atividade antimicrobiana. O composto foi obtido a partir da tiazolidina-2,4-diona proveniente da ciclização do ácido monocloroacético com tiouréia em meio aquoso. Em seguida foi condensado na posição 5 do anel heterocíclico com o 5-(4-nitrobenzaldeido), formando o 5-(4-nitrobenzilideno)- tiazolidina-2,4-diona. A atividade antimicrobiana foi avaliada pelo teste qualitativo de difusão em disco, usando microrganismos Gram-positivos, Gram- negativos e álcool-ácido resistentes, apresentando atividade antibacteriana para três bactérias Gram-positivas.
Palavras chaves
atividade antimicrobiana; derivados tiazolidínicos; tiazolidina
Introdução
A busca por substâncias terapeuticamente úteis para a cura ou controle de diversas enfermidades tem resultado na produção de novos fármacos com largo espectro de atividades biológicas. A existência de numerosas infecções bacterianas que abrangem os Países, principalmente aqueles em desenvolvimento e os efeitos indesejados dos atuais fármacos constitui importante desafio para a indústria farmacêutica. Isto visa à descoberta de novos compostos como potentes agentes antimicrobianos com menor efeito tóxico. Estudos sintéticos envolvendo a 4-tiazolidinona vêm sendo realizados desde o século XIX, a partir da elucidação de sua estrutura (LIBERMAN e LANGE, 1881). Vários tipos de reações estão sendo realizadas para obtenção de novos derivados tiazolidínico, tais como: sua ciclização com ácidos α-haloacéticos ou derivados destes com tiouréias conferem atividades especiais (St. LAURENT et. al., 2004) ou entre moléculas que possuem ligação dupla ou tripla conjugada com o grupo carbonila e compostos que apresentam a função tioamida como as tiossemicarbazonas (LIESEN et. al., 2008). A combinação do núcleo tiazolidínico com outros heterocíclicos é uma abordagem experimental que visa potencializar moléculas de drogas para alcançar novo perfil farmacológico com reforço da atividade ou redução da toxicidade (LESYK e ZIMENKOVSKY, 2004). As tiazolidinas são compostos, heterocíclicos e aromáticos, que possuem um anel de cinco membros. O nome tiazolidina deve-se à presença de átomos de enxofre e nitrogênio na molécula. A literatura descreve esses compostos como importantes, no arsenal terapêutico por possuírem propriedades com amplo espectro de ação (BONDE et al., 2004). Diante do exposto esse trabalho teve como objetivo a síntese de um novo derivado da tiazolidínico com ação antimicrobiana.
Material e métodos
Essa reação foi iniciada com a ciclização do anel tiazolidínico a partir da reação entre ácido monocloroacético e tiouréia em meio aquoso. O composto formado foi condensado na posição 5 do anel heterocíclico com o 4- nitrobenzaldeido em presença de etanol e piperidina resultando no produto 5-(4- nitrobenzilideno)-tiazolidina-2,4-diona. A reação ocorreu sob refluxo e agitação magnética a 70 °C. Após 10 horas, foi comprovado o término da reação por cromatografia em camada delgada. O produto foi submetido a banho de gelo, evaporado até metade do volume original, filtrado e recristalizado em THF. Em seguida foi filtrado em funil sinterizado, conduzido à estufa a 37 ºC e determinado suas constantes físicas. A atividade microbiológica foi testada com oito micro-organismos de diferentes classes: Gram-positivos Staphylococcus aureus, Micrococcus luteus, Bacillus subtilis, e Enterococcus faecalis; Gram- negativos Pseudomonas aeruginosa, Esherichia coli, e Serratia marcescens e o microrganismo álcool ácido resistente Mycobacterium smegmatis. A atividade antimicrobiana foi avaliada qualitativamente pelo método convencional de difusão em disco de papel (HOLLA, et al., 2003). Discos de 6 mm de diâmetros foram impregnados com uma solução do composto sintetizado em estudo e colocado sobre a superfície do meio semeado com os micro-organismos testes. Uma solução a 1 µg/mL, foi preparada e os discos foram impregnados com 100 µL da amostra, obtendo uma concentração de 10 µg em cada disco. As placas foram incubadas por 24-48 horas a 35 °C. Os resultados foram avaliados pela medição (em mm) do diâmetro do halo de inibição do crescimento do micro-organismo, formado em volta do disco. Os testes foram realizados em triplicata, os valores foram obtidos a partir da média aritmética e desvio padrão.
Resultado e discussão
Os resultados apresentados pelo produto reacional puro foram os seguintes: PF.
278-279 ºC, Rf. 0.52 no sistema (0.7:0.3 Hex./acet. de et.). Os dados
espectrométricos foram: 1HNMR (D2O/ND3, 300 MHz, ppm), (CH= (s), 1H, 8,01); (NH
(s), 1H, 13,37); Prótons Benzilidênicos (ddd, 2H, 7,71, J = 8,71 Hz); (ddd, 2H,
8.10, J = 8,71 Hz;). O rendimento da reação foi de 69%, considerado muito bom,
pela eficiência do método sintético utilizado para obtenção da molécula. A
reação foi processada de acordo com os, quanto antimicrobiana descritas na
metodologia. O composto sintetizado apresentou atividade antimicrobiana com
halos compatíveis com o padrão Canamicina para os seguintes micro-organismos
Gram-positivos: Staphylococcus aureus (20 mm), Enterococcus faecalis (10 mm) e
Bacillus subtilis (15 mm). Os halos apresentados para os representantes do grupo
Gram-positivos foram significativos, pois o composto inibiu o crescimento de
três linhagens Gram-positivas testadas. Porém, os halos formados foram
inferiores àqueles formados a partir da droga padrão ampicilina. Logo, o
derivado mostrou ser menos efetivo. O composto não formou halo para os micro-
organismos Gram-negativos, Bactéria álcool ácido resistente e Levedura testados,
indicando assim, inatividade para esses micro-organismos. O composto testado
revelou halo de 15 mm para o Bacillus subtilis superando o apresentado pelo
composto padrão testado (canamicina). Isto ficou evidenciado nessa avaliação da
atividade antimicrobiana do 5-(4-nitrobenzilideno)-tiazolidina-2,4-diona é que
entre os oito micro-organismos testados o composto inibiu o crescimento de
apenas três tipos de bactérias, sendo elas: Staphylococcus aureus, Enterococcus
faecalis e Bacillus subtili, com destaque para esse último onde exibiu halo
maior que o padrão testado.
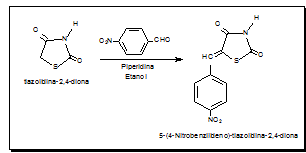
Fig. 1: Esquema de síntese do 5-(4- nitrobenzilideno)-tiazolidina-2,4-diona
Conclusões
A reação foi acompanhada por cromatografia de camada delgada, usando o revelador luz ultravioleta. A estrutura química do composto obtido foi determinada através de métodos físicos e espectrométricos convencionais. Foram determinados o Rendimento, Rf e Ponto de Fusão. O derivado tiazolidínico apresentou atividade antimicrobiana exclusiva para bactérias Gram-positivas. Foram inibidas pelo derivado tiazolidínico, Staphylococcus aureus, Enterococcus faecalis e Bacillus subtilis. Porém a atividade apresentada contra Staphylococcus aureus com halo de (20 mm), superou a Canamicina droga padrão.
Agradecimentos
Ao CNPq/UFPE pelo apoio dado. Ao laboratórios de Fármacos e micro-organismos e seus alunos pelos testes antimicrobianos realizados.
Referências
Holla, B. S.; Malini, K. V.; Rao, B. S.; Sarojini, B. K.; Kumari, N. S. Eur. J. Med. Chem. 2003, 38, 313.
Bonde, C. G.; Gaikwad, N. J.; Bioorg. Med. Chem. 2004, 12, 2151.
Libermann, C.; Lange, A. Ann. v.207, p.121, 1881. Chem. Rev. v.61, n.5, p.464, 1961.
Liesen, A. P.; Aquino, T. M.; Lima, J. G.; Faria, A. R.; Alves, A. J.; Góes, A. J. S., Quimica Nova, Vol. 31, No. 2, 369-376, 2008
Lesyk, R. B.; Zimenkovsky, B. S.. Current Organic Chemistry, v. 8, n. 16, p. 1547-1577, 2004.
St. Laurent, D R.; Dedong - Wu, Q. G.; Serrano-Wu, M. H.; Tetrahedron Lett. 2004, 45, 1907.










