ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Leonardo Jr, C.S. (IQ-UNESP) ; Mininel, F.J. (IQ-UNESP) ; Santos, L.C. (IQ-UNESP)
Resumo
Terminalia catappa Linn. pertence à Família Combretaceae e é comumente chamada amendoeira-da-praia ou chapéu de sol. É originária da Malásia, mas muitas vezes cultivada e muito característica da costa brasileira. A partir do extrato hidroalcoólico das folhas foram detectados como constituintes principais a substância majoritária punicalagina (anômeros α e β), o composto punicalina, ácido galágico e ácido elágico. A configuração absoluta dos anômeros da punicalagina foi estabelecida por experimentos de dicroísmo circular (DC). A determinação quantitativa dos principais metabolitos secundários foi realizada por HPLC-PDA, possibilitando a determinação da concentração e teor (%) de metabólitos presentes no extrato hidroalcoólico.
Palavras chaves
T. catappa; COMBRETACEAE; punicalagina
Introdução
As plantas medicinais vêm sendo utilizadas por um público cada vez maior e recebendo incentivo da própria Organização Mundial da Saúde, que recomendou aos países membros que desenvolvessem pesquisas visando o uso da flora com propósitos terapêuticos. O principal fator a contribuir para o crescimento dessa prática terapêutica consiste no desenvolvimento de estudos químicos e farmacológicos que comprovem a eficácia das plantas medicinais. A Família Combretaceae possui distribuição predominantemente pantropical, sendo que no Brasil ocorrem cinco gêneros nativos com aproximadamente 60 espécies. Terminalia catappa Linn (da família Combretaceae) cresce em regiões tropicais e subtropicais, particularmente localizadas em áreas costeiras. Essa espécie é nativa de áreas próximas a regiões costeiras do Oceano Índico. Trata-se de uma árvore decídua, de 6-12 m de altura, podendo chegar até 20 m nas regiões de origem. O tronco é curto e canelado, com casca áspera de cor acinzentada. Apresenta folhas coriáceas, simples, com nervuras bem visíveis, concentradas na extremidade dos ramos e que adquirem coloração amarelada ou avermelhada antes de caírem. Várias atividades biológicas já foram descritas para a planta, como antioxidante, antiinflamatória, hepatoprotetora e antidiabética. Essas atividades foram atribuídas, principalmente, à presença de compostos fenólicos, sendo que alguns destes já foram isolados e caracterizados. Os taninos hidrolisáveis são os principais compostos associados à atividade antioxidante, sendo a punicalagina e a punicalina os compostos mais abundantes, encontrados nas folhas, associados a este tipo de ação.
Material e métodos
As folhas de T. catappa foram coletadas na orla da praia da cidade de Santos-SP, com autorização da prefeitura, no mês de abril de 2010, identificadas pelo botânico Paulo Salles. As folhas de T. catappa coletadas (524,6 g) foram submetidas ao processo de secagem em estufa a 50ºC por 6 dias consecutivos. Após secagem, as mesmas foram trituradas e moídas em moinho de facas. O pó obtido foi extraído com etanol 70%, por meio de percolação exaustiva. O pó foi intumescido com 2 litros de etanol a 70%. Em seguida, o percolador foi empacotado homogeneamente com a mistura (pó + etanol a 70%) e o efluente foi coletado na vazão de 2,0 mL/min/Kg. Após a extração, o líquido extrator foi rotaevaporado sob pressão reduzida, em temperatura menor que 45°C. O extrato bruto foi transferido para um vidro e deixado em capela até completa eliminação do solvente. Um total de 14 g de extrato de hidroalcóolico (7:3, v/v) foi dissolvido em 500 mL de água-metanol (8:2, v/v) e particionado sucessivamente com hexano. A fração hidrometanólica foi utilizada para purificação da mistura de anômeros da punicalagina em CLAE-preparativo. Para a quantificação, a curva foi construída usando os anômeros da punicalagina isolada. Punicalaginas totais (anômeros α + β) em folhas de T. Catappa foi avaliada a partir da somatória das curvas analíticas correspondentes a cada anômero. Obteve-se uma solução estoque de 4000 µg/mL. A partir da solução estoque foram feitas diluições seriadas a (2000, 1000, 500,250, 125, 62,50, 31,25 µg/mL). Para estabelecimento da configuração absoluta da mistura de anômeros da punicalagina procedeu-se com a análise de dicroísmo circular, utilizando-se CLAE-DAD-DC.
Resultado e discussão
No cromatograma do extrato hidroalcoólico obtido por CLAE-DAD se destacam um
total de seis picos principais, com espectros na região de UV característicos de
punicalagina e ácido elágico. A punicalagina se apresenta com dois picos, sendo
um semelhante ao outro em relação ao espectro na região de UV. Os picos
apresentam um máximo de absorção λmax 218 nm, 260 nm e 379 nm,
característicos do cromóforo galagil. Este fato indica que os compostos são
isolados sob a forma de anômeros (punicalaginas α e β), portanto os dois picos
são pertencentes a uma única substância. Na quantificação, a análise por
regressão linear das respostas da área dos picos (y) em relação
ao volume de injeção (x) produziu as seguintes equações: y= 11861x+ 37326
para α-punicalagina, y= 16830x + 44760 para β-punicalagina e y=
28691x + 82086 para punicalagina total, A partir das curvas de
calibração foram obtidos os coeficientes linear (82086) e angular(28691), o
coeficiente de correlação (r2 = 0,998) e os limites de detecção (LOD = 9,44) e
de quantificação (LOQ = 28,61). O espectro de DC dos anômeros da
punicalagina evidencia um Efeito Cotton positivo pronunciado em cerca de
235 nm e outro em aproximadamente 265 nm. Pode ser
observado também um Efeito Cotton positivo, menos intenso, em 330 nm, devido à
presença de grupos galoil e grupos hexahidroxidifenoíla (HHDP). O Efeito Cotton
em cerca de 330 nm é devido, provavelmente, aos grupos galoil ligados aos anéis
B e D da punicalagina e esterificados às hidroxilas dos carbonos C-3 e C-6 do
resíduo de açúcar. O composto punicalagina apresenta, portanto, a seguinte
nomenclatura: 2,3-(S)-hexahidroxidifenoil-4,6-(S,S)-galagil-D-glicose.
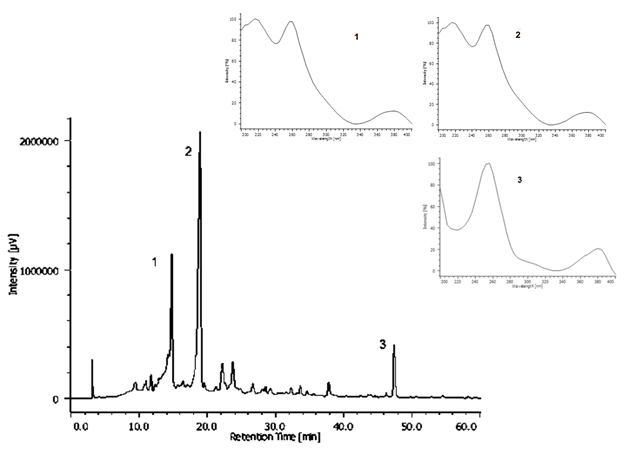
Cromatograma do extrato hidroalcoólico com espectros de UV dos picos majoritários (anômeros da punicalina, picos 1 e 2) e ácido elágico (pico 3).
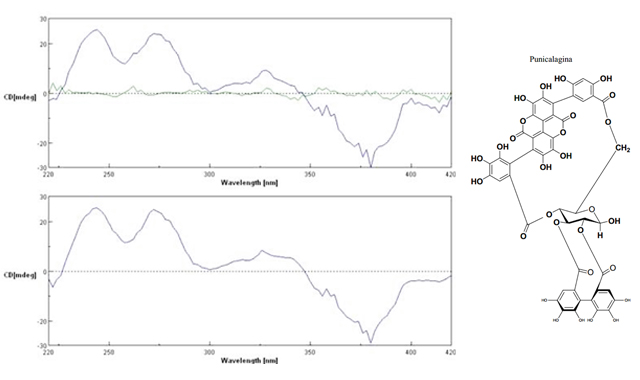
Espectro de dicroísmo circular (DC) da punicalagina demonstrando efeito Cotton positivo, e estrutura química com conformação (S)-HHDP.
Conclusões
O estudo químico do extrato das folhas de T. catappa por CLAE-DAD-DC possibilitou determinar os principais metabólitos secundários que constituem as folhas da espécie, além de permitir a observação do comportamento de anômeros (punicalagina) neste tipo de detector. Através da quantificação, foi possível determinar a quantidade de punicalagina presente no extrato e a validação do método, e como esta está relacionada à atividades biológicas, esta se torna uma determinação essencial para o trabalho. A análise por dicroísmo circular possibilitou estabelecer a configuração absoluta dos anômeros.
Agradecimentos
Ao Instituto de Química de Araraquara, ao Projeto Biota-Fapesp e ao CBQ.
Referências
CASTRO, H.G.; FERREIRA, F.A.; SILVA, D.J.H.; MOSQUIN, P.R. A Contribuição ao Estudo das Plantas Medicinais: Metabólitos Secundários.Universidade Federal
de Viçosa, p. 1, Ed. 2, 2004. CHEN, P.S.; LI, J.H.; LIU, T.Y.; LIN, T.C.; Folk medicine Terminalia catappaand its
major tannin component, punicalagin, are effective against bleomycin-induced
genotoxicity in Chinese hamster ovary cells. Cancer Lett, v. 152, p. 115-122, 2000.FAN, Y.M.; XU, L.Z.; GAO, J.; WANG, Y.; TANG, X.H.; ZHAO, X.N.; ZHANG,
Z.X. Phytochemical and antiinflammatory studies on Terminalia catappa. Fitoterapia, v. 75, 253-260, 2004. LIN, C.C.; CHEN, Y.L.;LIN, J.M.; UJIIE, T. Evaluation of the antioxidant and
hepatoprotective activity of Terminalia catappa. Am. J. Chin. Med.v. 25, p. 153-161, 1997. NAGAPPA, A. N.; THAKURDESAI, P. A.; VENKAT RAO, N.;JIWAN-SINGH, S.
Antidiabetic activity of Terminalia catappa Linn fruits. Journal of Ethnopharmacology, v. 88, n. 1, p. 45-50, 2003. OKUDA, T.; YOSHIDA, T.; HATANO, T.; KOGA, T.; TOH, N.; KURIYAMA, K. Circular dichroism ofhydrolyzable tannins. I. Ellagitannins and gallotannins. Tetrahedr. Lett. 1982a, 23, 3937–3940. OKUDA, T.; YOSHIDA, T.; HATANO, T.; KOGA, T.; TOH, N.; KURIYAMA, K. Circular dichroism ofhydrolyzable tannins. II. Dehydroellagitannins. Tetrahedr. Lett.
1982b, 23, 3941–3944.RIBANI, M.; BOTTOLI, C.B.G.; COLLINS, C.H.; JARDIM, I.C.S.; MELO, L.F.C. validação em métodos cromatográficos e letroforéticos. Química Nova, v. 27, n.5, p. 771-780, 2004. SOUZA VC, LORENZI, H. Botânica Sistemática: Guia Ilustrado para identificação das famílias de angiospermas da flora brasileira. Baseado em APGII, Nova Odessa S.P, Instituto Plantarum, 2005, 465 p. THOMSON, L.; EVANS, B. Species Profiles for PacificIsland Agroforestry: Terminalia catappa(Tropical Almond), 2006.
<http://www.agroforestry.net/tti/T.catappa-tropical-almond.pdf>.Acesso em 28 de
jun. de 2014.










