ISBN 978-85-85905-10-1
Área
Química Orgânica
Autores
Oliveira, A.R.C. (UFERSA) ; Nascimento, J.N. (UFERSA) ; Carlos, T.A.V. (UFERSA) ; Castelo Branco, F.A.A. (UFERSA) ; Barbosa, M.C. (UFERSA) ; Trindade Neto, C.G. (UNP) ; Santos, Z.M. (UFERSA)
Resumo
A quitosana é um biopolímero que se obtém através do processo de desacetilação da quitina, sendo encontrado carapaça de crustáceos. A quitosana apresenta grande aplicabilidade em diversas áreas, como na indústria farmacêutica, alimentícia, tratamento de efluentes dentre outras. A quitosana e a quitina são formadas por unidades 2-acetamido-2-desoxi-D-glicopiranose e 2-amino-2-desoxi-D-glicopiranose, diferindo uma da outra a proporção de cada unidade. A quitina possui maior número de grupos amida, já a quitosana um maior número grupos amino. Neste trabalho a quitosana foi sintetizada a partir da quitina proveniente da casca do camarão. Além disso, a mesma caracterizada quanto a seu grau de desacetilação, massa molecular viscosimétrica média, espectroscopia de infravermelho.
Palavras chaves
Quitosana; Quitina; Grau de desacetilação
Introdução
A quitina é o segundo polissacarídeo mais abundante na natureza, perdendo apenas da celulose, a qual arranja-se em alfa hélice estabilizada por ligações de hidrogênio (BEZERRA, 2011). A quitosana, obtida a partir da quitina, é um polissacarídeo que apresenta uma estrutura formada por unidades D-glicosamina e por N-acetil-D-glicosamina ligadas por ligações β(1→4). A diferença está entre os grupos funcionais, que quando comparados é possível observar, os grupos hidroxilas estão arranjados na estrutura geral do carboidrato para a celulose e os grupos aminos para quitosana (AZEVEDO, 2007). Uma quitina completamente desacetilada raramente é obtida, visto que são necessárias várias reações consecutivas que também favorecem a sua despolimerização. Dessa forma, o termo quitosana abrange um grupo de copolímeros que apresentam entre 50-60% de unidades 2-amino-2-desoxi-D-glicopiranose (CAMPANA-FILHO et al., 2007). Segundo Janegitz (2007) a quitosana é um ótimo sorvente de metais pesados, ou seja, possui grande capacidade de formar complexos com íons de metais de transição devido a presença do grupo amino presente em sua estrutura. Biomateriais produzidos a partir de quitosana tem utilizações sugeridas como bioadesivos, material de bandagem, molde para enxerto de pele, agente hemostático, material para sutura, e até mesmo material para lentes de contato, na forma de filmes, géis, cápsulas, micro cápsulas ou soluções (SPIN-NETO et al, 2008). Neste trabalho realizou-se processos para a obtenção da quitina partindo-se da casca do camarão e, em seguida, realizou-se síntese da quitosana pela desacetilação da quitina. Posteriormente, realizou-se caracterizações na quitosana para obter a comprovação de sua obtenção.
Material e métodos
Desproteinização: As cascas foram postas em contato com NaOH 6 mol/L, sob agitação constante por 4 h a temperatura de 65 ºC ±1. Ao fim da reação, as casca foram lavadas em água até pH neutro. Desmineralização: As cascas foram colocadas em HCl à 6 mol/L, sob agitação por 4 h. Em seguida, as mesmas foram lavadas com água até pH neutro. Despigmentação: As cascas foram submersas em CHCl3 por 4 h, em seguida foram lavadas e secas a 65 ºC durante 24 h. Obteve-se a quitina. Desacetilação: Uma massa de quitina foi posta em contato com solução mista de NaOH a 60 % e NaBH4 10%. O sistema ficou sob agitação por 5 h a 120 °C em sistema de refluxo. Após, a quitosana foi lavada com água e colocada para secar a 65 °C por 18 h. Teor de Sólidos: Uma massa de quitosana foi pesada e, em seguida, foi levada a uma estufa a 105 °C até massa constante. Massa Molar Viscosimétrica Média: O método usado seguiu o utilizado por PRASHANTH (2001), onde uma massa de quitosana foi dissolvida em solução tampão de CH₃COOH 0,5 mol/L e CH3COONa 0,2 mol/L por 24 h sob agitação. Foram determinadas as viscosidades das amostras, com temperatura 25°C ± 0,5. Obtendo a viscosidade intrínseca, determinou-se a massa molecular utilizando a equação de Mark-Houwink-Sakurada. Grau de Desacetilação: Uma solução de quitosana, com massa de 0,1 ± 0,0001 foi dissolvida em 40 mL de HCl 0,048 mol/L, a qual foi mantida sob agitação por período de 18 h a 25 °C ± 1. Em seguida, adicionou-se 100 mL de água, e titulou- se com NaOH 0,1363 mol/L, registrando-se as variações da condutividade. Após, calculou-se o GD aplicando a equação desenvolvida por SANTOS et al, (2009). Espectroscopia de Infravermelho: O espectro de infravermelho da quitosana foi obtido em um espectrofotômetro, usando técnica de transmissão em pastilhas de KBr.
Resultado e discussão
A partir da figura 1.a) foi feito a regressão e obteve-se a viscosidade
intrínseca, utilizada para a obtenção da massa molar viscosimétrica média por
meio da equação de Mark–Houwink-Sakurada. Os valores das constantes K = 3,5 x
10-4 e α = 0,76 são característicos do conjunto soluto solvente utilizado
(PRASHANTH, 2001). A massa molar obtida foi 1,24x 105 g•mol-1 estando na mesma
ordem de grandeza de quitosanas industriais (SANTOS et al, 2013).
A quitosana sintetizada apresentou teor de sólido de 86,31 %.
Na figura 1.b) vê-se três regiões distintas. A primeira, sendo uma abrupta
diminuição da condutividade devido a neutralização do HCl livre pelo NaOH. A
segunda corresponde à neutralização dos grupos amino protonados e a última
corresponde ao excesso de NaOH. O grau de desacetilação foi de 77,3 ± 2,
calculado pela diferença de volume na segunda região, utilizando a equação
desenvolvida por SANTOS et al, (2009).
Na Figura 2 observa-se uma banda com aspecto largo, que apresenta máximo em
torno de 3.453 cm-1. Vê-se um ombro próximo de 3.293 cm-1, devido a deformação
axial de N-H. A banda de amida I pode ser mascarada por uma banda em 1.659 cm-1
relacionada com a deformação axial do grupo OH da água e da quitosana. Na região
de 1.599 cm-1 está a banda de deformação angular da ligação N-H, oriundo do
grupo amino da desacetilação da quitina. A banda de amida II está próximo de
1.560 cm-1, e não é visível nesse espectro, podendo ser mascarada pela absorção
do grupo NH2.
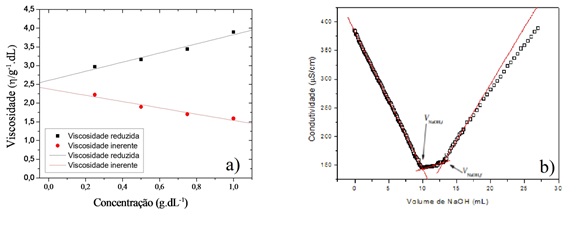
a) Viscosidade reduzida/inerente x concentração de quitosana. b) Condutividade x volume de NaOH.
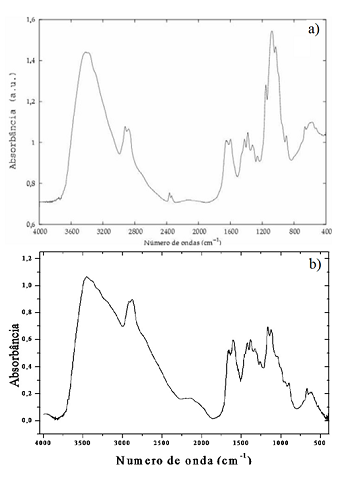
Espectro de Infravermelho para a quitosana. a)sintetizada em processo industrial. b)sintetizada neste trabalho.
Conclusões
Foi possível sintetizar a quitosana pelos métodos empregados neste trabalho, onde por meio da análise de infravermelho pôde-se obter bandas de absorção característicos da quitosana. O grau de desacetilação da quitosana foi de 77%, o qual é relatado na literatura que a partir de 60% o polímero já pode ser considerado como quitosana (CAMPANA- FILHO et al., 2007). A massa molecular viscosimétrica média foi de 1,24x 105 g/mol, sendo este valor coerente com os encontrados na literatura para a quitosana (NETO, 2008).
Agradecimentos
Referências
AZEVEDO, V. V. C. Quitina e Quitosana: aplicações como biomateriais. Revista Eletrônica de Materiais e Processos, v. 2, p. 27–34, 2007.
BEZERRA, A. M. Síntese e avaliação físico-químicas e biologicas de derivados de quitosana de alta e baixa massa molecular. UNIVERSIDADE DE SÃO PAULO, 2011.
CAMPANA-FILHO, S. P.; BRITTO, D. D., CURTI, E.; ABREU, F. R., CARDOSO, M. B.; BATTISTI, M. V.; LAVALL, R. L. Extração, estruturas e propriedades de α- e β-quitina. Química Nova, 30(3), 644-650, 2007.
DOS SANTOS, Z. M.; PEREIRA, M. R.; FONSECA, J. L. C. Rheology and dynamic light scattering of octa-ethyleneglycol-monododecylether/chitosan solutions. Carbohydrate polymers, v. 98, n. 1, p. 321-330, 2013.
HARISH PRASHANTH, K. V.; KITTUR, F. S.; THARANATHAN, R. N. Solid state structure of chitosan prepared under different N-deacetylating conditions. Carbohydrate Polymers, v. 50, n. 1, p. 27-33, 2002.
JANEGITZ, B. C.; JUNIOR, L. H. M.; FATIBELLO-FILHO, Orlando. Determinação voltamétrica por redissolução anódica de Cu (II) em águas residuárias empregando um eletrodo de pasta de carbono modificado com quitosana.Química Nova, v. 30, n. 7, p. 1673-1676, 2007.
NETO, C. G. T. Membranas de quitosana micro e macroporosas: preparo, caracterização e estudos de permeabilidade. 2008. Tese (Doutorado em Química) – Programa de Pós-Graduação em Química – Universidade Federal do Rio Grande do Norte, Natal – RN.
SPIN-NETO, R. S; PAVONE, C.; DE FREITAS, R. M..; MARCANTONIO, R. A. C.; MARCANTONIO-JÚNIOR, E. Biomateriais à base de quitosana com aplicação médica e odontológica: revisão de literatura. Revista de Odontologia da UNESP, v. 37, n. 2, p. 155-161, 2008.










