ISBN 978-85-85905-10-1
Área
Alimentos
Autores
Cabral, A.M. (UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE) ; Moura, M.F.V. (UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE) ; Silva, D.R. (UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE)
Resumo
Neste trabalho, um método cromatográfico simples e rápido para identificação simultânea de Benzilpenicilina G Benzatina (PENG), Oxitetraciclina (OTC), Sulfato de Gentamicina (GEN), Sulfadoxina (SDX) e Trimetoprim (TMP) foi desenvolvido. A separação dos compostos foi realizada por cromatografia liquida de rápida eficiência acoplado a arranjo de fotodiodos (UFLC-DAD). Os procedimentos foram condicionados utilizando coluna em fase reversa C8 com fase móvel água e Acetonitrila 80:20 (v/v) em gradiente e fluxo de 1 mLmin-1. Os resultados apresentaram vantagens tais como eluição dos compostos em faixa de tempo de retenção (0,5 – 6 min) e satisfatória resolução dos picos garantido, principalmente, pela ausência de misturas interferentes que podem sobrepor-se aos picos dos antibióticos.
Palavras chaves
UFLC - DAD ; Antibióticos; Interferentes
Introdução
Os antimicrobianos da classe dos b-lactâmicos, aminoglicosídeo e sulfonamidas são utilizados para manutenção da saúde de animais produtores de alimentos. As sulfonamidas e diaminopirimidinas são utilizados para o tratamento de animais produtores de leite acometidos de doenças infecciosas, como a mastite. A administração de produtos não marcados em fêmeas lactantes e não conformidade com um período de carência de 24 horas para ordenha, é ilegal, resulta em resíduos de medicamentos veterinários em leite. A ausência de um devido monitoramento pode resultar em altas concentrações de resíduos no leite, que põem em perigo a saúde dos consumidores (SCHENCK; CALLERY, 1998). As consequências da permanência podem ser nefastas tais como, intolerância aos antibióticos, hipersensibilidade às penicilinas, reações alérgicas e interferência no processo industrial dos derivados do leite (BERENDSEN et al., 2010; BOHM; STACHEL; GOWIK, 2009; LOPEZ et al., 2008). O Ministério da Agricultura Pecuária e Abastecimento do Brasil (MAPA) estabelece métodos e admitem limite máximo de resíduos (LMR). A Cromatografia líquida de alta eficiência (HPLC) é utilizada para a análise simultânea de penicilinas em fluidos biológicos, formulações farmacêuticas, produtos alimentícios de origem animal, utilizando diferenciados detectores (BAILÓN-PÉREZ et al., 2009; KANTIANI et al., 2009; KARAGEORGOU; SAMANIDOU, 2011; RAMBLA-ALEGRE et al., 2011; RIEDIKER; DISERENS; STADLER, 2001; VAN HOLTHOON et al., 2010). Este trabalho utiliza cromatografia liquida de rápida eficiência acoplada a arranjo fotodiodos (UFLC-DAD) para identificação de compostos antimicrobianos a base de Oxitetraciclina (OTC), Trimetoprim (TMP), Sulfato de Gentamicina (GEN), Sulfadoxina (SDX) e Benzilpenicilina G Benzatina (PENG).
Material e métodos
1. Reagentes e Amostras Todos os reagentes utilizados foram grau HPLC, sendo acetonitrila fabricado por Merck (Darmstad, Germany) e água (resistividade > 16 MΩ). Soluções injetáveis de medicamentos antimicrobianos foram filtradas em nylon (13 mm x 0.45 µm). Os procedimentos para preparo foram descritos em Farmacopeia Americana (USP XXVIII, 2007; 2011). As soluções trabalho estão em faixa de concentrações descritas OTC (50 µgmL), TMP 10 µgmL, GEN 100 µgmL, SDX 50 µgmL-1 e PENG de 600.000 UI estoque equivalente a 77, 6367 mgmL (400 µgml) preparado em banho ultrassónico. Cada solução foi preparada da adição de padrão externo para OTC (0,5; 0,2; 0,1; 0,05; 0,01 µgmL), TMP (0,1; 0,05; 0,04; 0,02; 0,01; 0,002 µgmL), GEN (0,1; 0,4; 0,2; 0,1; 0,02 µgmL), SDX (0,5; 0,2; 0,1; 0,05; 0,01 µgmL) e PENG (0,5; 0,2; 0,1; 0,05; 0,01 µgmL). 1.2 Instrumentação, Condições do Sistema Cromatográfico e A separação dos compostos foi realizada em sistema UFLC , MODELO LC-20. A coluna de fase reversa de C8 (4,6 mm x 25 cm, 5 μm). A composição da fase móvel tem sido água e acetonitrila 80:20 (v/v). As melhores condições foram em fluxo de 1 mLmin-1, a temperatura era de 40 °C e modo de injeção por loop com limite 5µL. O detector utilizado foi com arranjo de foto diodos, o comprimento de onda foi selecionado de acordo com o máximo de absorbância para cada família de beta-lactâmicos, sendo que para é de 220 nm referenciado. As Medições foram realizados em 220, 266, 280, 300 e 358 nm. Dados coletados pelo
Resultado e discussão
Na separação cromatográfica dos antibióticos foram consideradas as condições previstas pela eficiência do sistema de cromatografia e seletividade de colunas de cromatografia (SPISSO et al., 2007). Levou-se em consideração as condições expostas pelo sistema cromatográfico UFLC – DAD e as referenciadas pela literatura utilizadas na identificação de antibióticos da classe da tetraciclina que são as de sílica de fase reversa C8 ou C18. Desta maneira, a utilização de uma coluna de HPLC de fase reversa C8 com um grupo polar incorporado causa proximidade com a superfície da sílica, permitindo melhor seletividade, reduzindo a largura do pico e de retenção para as tetraciclinas estudados em comparação com as colunas a base de sílica alquilo C8 e não altera a ordem de eluição dos compostos. O objetivo deste estudo sobre o controle de qualidade dos medicamentos veterinários, substâncias que necessitam certificados para que seus resíduos são controlados e o LMR não devem ser ultrapassados para segurança dos alimentos. Para cada um dos analitos investigados, foram empregados procedimentos simples e capaz de detectar dentre da faixa de concentração da curva analítica e em acordo com o LMR. O planejamento das condições cromatográficas minimizar os erros nas medidas e prevenir aparecimento de sobreposição de picos interferentes. As medidas foram preconizadas em seguidas injeções em níveis de 1,2, 3 e 4 uL, conforme mostra a Tabela 1 presente na Figura 2 que mostra a faixa de concentração escolhida está de acordo com o limite máximo de resíduos em matriz leite bovino que varia entre 50 – 200 µgmL. Os resultados mostraram que o método desenvolvido é adequado para identificar os antimicrobianos em medicamentos veterinários estudados, porque seus erros foram minimizados.
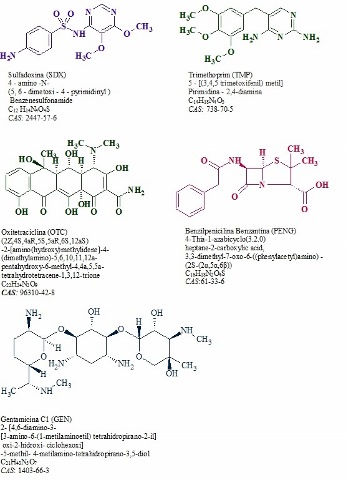
A Figura 1 mostra as principais informações e estrutura química dos compostos (OTC, TMP, GEN, SDX e PENG).
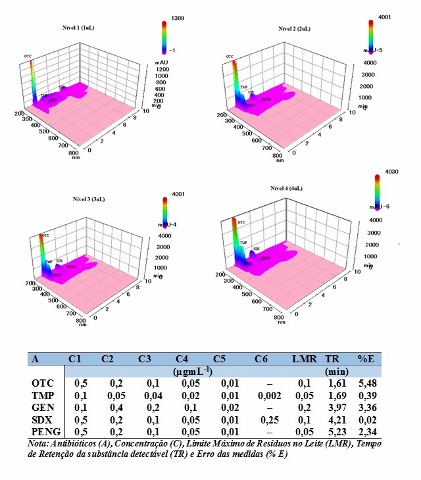
A Figura 2 mostra a separação cromatográfica de OTC, TMP, GEN, SDX e PENG. O procedimento está em quatro níveis, com respectivos erros das medidas.
Conclusões
O método desenvolvido para identificação simultânea de OTC, TMP, GEN, SDX e PENG em soluções injetáveis de medicamentos veterinários mostrou resultados satisfatórios na identificação deste antibiótico, utilizando UFLC – DAD porque combina a especificidade, com sensibilidade, reprodutibilidade, custo-efetividade e rápida obtenção do sinal analítico dos compostos.
Agradecimentos
Os autores agradecem a CAPES e UFRN pelo suporte.
Referências
BAILÓN-PÉREZ, M. I. et al. Trace determination of 10 beta-lactam antibiotics in environmental and food samples by capillary liquid chromatography. Journal of chromatography. A, v. 1216, n. 47, p. 8355–61, 20 nov. 2009.
BERENDSEN, B. et al. Evidence of natural occurrence of the banned antibiotic chloramphenicol in herbs and grass. Analytical and bioanalytical chemistry, v. 397, n. 5, p. 1955–63, jul. 2010.
BOHM, D. A; STACHEL, C. S.; GOWIK, P. Multi-method for the determination of antibiotics of different substance groups in milk and validation in accordance with Commission Decision 2002/657/EC. Journal of chromatography. A, v. 1216, n. 46, p. 8217–23, 13 nov. 2009.
KANTIANI, L. et al. Fully automated analysis of beta-lactams in bovine milk by online solid phase extraction-liquid chromatography-electrospray-tandem mass spectrometry. Analytical chemistry, v. 81, n. 11, p. 4285–95, 1 jun. 2009.
KARAGEORGOU, E. G.; SAMANIDOU, V. F. Development and validation according to European Union Decision 2002/657/EC of an HPLC-DAD method for milk multi-residue analysis of penicillins and amphenicols based on dispersive extraction by QuEChERS in MSPD format. Journal of separation science, p. 1893–1901, 4 jul. 2011.
LOPEZ, M. I. et al. Multiclass determination and confirmation of antibiotic residues in honey using LC-MS/MS. Journal of agricultural and food chemistry, v. 56, n. 5, p. 1553–9, 12 mar. 2008.
RAMBLA-ALEGRE, M. et al. Application of a liquid chromatographic procedure for the analysis of penicillin antibiotics in biological fluids and pharmaceutical formulations using sodium dodecyl sulphate/propanol mobile phases and direct injection. Journal of chromatography. A, v. 1218, n. 30, p. 4972–81, 29 jul. 2011.
RIEDIKER, S.; DISERENS, J. M.; STADLER, R. H. Analysis of beta-lactam antibiotics in incurred raw milk by rapid test methods and liquid chromatography coupled with electrospray ionization tandem mass spectrometry. Journal of agricultural and food chemistry, v. 49, n. 9, p. 4171–6, set. 2001.
SCHENCK, F. J.; CALLERY, P. S. Chromatographic methods of analysis of antibiotics in milk. Journal of chromatography. A, v. 812, n. 1-2, p. 99–109, 3 jul. 1998.
SPISSO, B. F. et al. Validation of a high-performance liquid chromatographic method with fluorescence detection for the simultaneous determination of tetracyclines residues in bovine milk. Analytica chimica acta, v. 581, n. 1, p. 108–17, 2 jan. 2007.
VAN HOLTHOON, F. et al. Quantitative analysis of penicillins in porcine tissues, milk and animal feed using derivatisation with piperidine and stable isotope dilution liquid chromatography tandem mass spectrometry. Analytical and bioanalytical chemistry, v. 396, n. 8, p. 3027–40, abr. 2010.
United States Pharmacopeia 30 National Formulary 24, United States Pharmacopeial Convention, Inc. Rockville, MD: 2007
United States Pharmacopeia. National formulary. United State Pharmacopeial Convention Inc. Validation of Compendial procedures; 2011; 779–782










