ISBN 978-85-85905-10-1
Área
Alimentos
Autores
Oliveira, K.C. (UFRN) ; Carvalho, G.C. (UFRN) ; Castro, H.G.C. (UFRN) ; Junior, J.H.S. (UFRN) ; Moura, M.F.V. (UFRN)
Resumo
A degradação dos camarões ocorre mais rapidamente do que dos peixes por causa de alguns fatores gerando aminas bioativas rapidamente. As altas ou baixas concentrações de espermidina possuem importância em relação à toxicidade, pois são indicadores do grau de frescor e de deterioração dos alimentos. Utilizou-se cromatografia liquida com detector iônico usando como solvente extrator o ácido tricloroacético a 5% (TCA). Determinou-se as concentrações de espermidina em amostras de camarões fresco, cozido e em camarões mantidos a temperatura ambiente por 24 h. Também investigou-se semanalmente a concentração da espermidina em camarões congelados, verificou-se que a espermidina pode ser tida como indicadores de qualidade do camarão visto que sua concentração diminui semanalmente.
Palavras chaves
Espermidina; Litopenaeus Vannamei; Cromatografia Iônica
Introdução
A degradação dos camarões ocorre mais rapidamente do que nos peixes por causa de alguns fatores: a alta concentração de metabólitos de baixo peso molecular oriundos da autólise do hepatopâncreas (MADRI, 1998); substâncias não nitrogenadas e aminoácidos livres que servem como substrato para o aumento de microrganismos e as alterações físico-químicas degradativas como oxidação de lipídios e hidrólise de proteínas, que formam compostos voláteis como amônia e gás sulfídrico, e não voláteis como as aminas bioativas (MONTEIRO, 2012). A determinação das concentrações de histamina, agmatina, tiramina, putrescina, cadaverina, espermidina e espermina são de grande importância, não só do ponto de vista da toxicidade, mas como indicadores do grau de frescor e de deterioração nos alimentos e está associado a condições sanitárias inadequadas na produção (HALÁSZ et al, 1994; BUENO-SOLANO, 2012). Aminas secundárias nitrosáveis (agmatina, espermina, espermidina) podem formar nitrosaminas por reação com nitrito e produzir compostos carcinogênicos (SMITH, 1981; HALÁSZ, 1994). Altos níveis de espermidina pode causar toxicidade renal, e pode afetar a coagulação do sangue, pressão arterial, batimento cardíaco e a respiração (MAGA, 1978). Os níveis de histamina, putrescina e cadaverina geralmente aumentam durante a deterioração dos alimentos, enquanto que os níveis de espermina e espermidina diminuem durante este processo (BRINK et al., 1990). Os métodos analíticos mais amplamente utilizados para identificação e quantificação de aminas bioativas e aminoácidos são cromatografia líquida de alta eficiência (CLAE/HPLC) e eletroforese capilar, que se combina com diferentes detectores (BUENO-SOLANO, 2012). Este trabalho tem como objetivo determinar a concentração de espermidina
Material e métodos
Os reagentes utilizados foram de grau analítico, exceto os solventes que foram de grau cromatográfico. A água foi ultrapura obtida do Sistema Milli-Q Plus. O padrão de espermidina (EPD) foi adquirido da Sigma-Aldrich Brasil Ltda. A metodologia incluiu três etapas: adequação das condições da cromatografia (fonte de ionização, analisador, aquisição dos dados), extração do analito e preparação das amostras, conforme normatizado pelas legislações do MAPA (Ministério da Agricultura, Pecuária e Abastecimento do Brasil). As amostras foram coletadas em uma fazenda de carcinicultura na cidade de Arez/RN. Utilizou- se 3 kg da amostra, com camarões pesando em média 15 g, que foram acondicionados em sacos de polietileno, e transportados em bolsa térmica com gelo. O procedimento de análise incluiu as etapas de quarteamento, trituração, pesagem, extração, centrifugação, filtração (filtro de seringa de 0,22 µm) e leitura em cromatógrafo. As amostras foram definidas como: camarões frescos (CF), camarões cozidos (CC), camarões com vinte e quatro horas a temperatura ambiente (C24), camarões com uma semana (CS1), camarões com duas semanas (CS2), camarões com três semanas (CS3) e camarões com quatro semanas de congelamento (CS4). O gradiente foi otimizado com fase móvel de ácido metilsulfônico (MSA – ThermoScientific) gerado eletroanaliticamente. Utilizou um cromatógrafo a líquido com detector condutimétrico (ICS 2100 – DIONEX), a fase móvel foi o ácido metilsulfônico 3 mmol L-1 com gradiente e a coluna foi a IonPac CS18 com fase reversa. O gradiente do eluente foi o MSA a 3 mmol L-1 a partir de 0 – 20 min, 18 mmol L-1 de 20 – 25 min, 45 mmol L-1 de 25 – 35 min e 3 mmol L-1 de 35 – 40 min. O fluxo utilizado foi de 0,25 mL min-1, a temperatura foi de 40 °C, o volume de injeção foi de 5 µL.
Resultado e discussão
A partir da solução padrão da espermidina foi construída uma curva analítica na
faixa de concentração de 0,1 a 2,0 mg L-1 cuja equação linear e R2 encontram-se
na Figura 1. Os limites de detecção e de quantificação foram, respectivamente,
0,124 e 0,414 mg L-1.
A espermidina apresentou concentração de 2,57 ± 0,01 mg L-1 no camarão fresco
(CF), 1,27 ± 0,002 no camarão cozido (CC) e 12,75 ± 0,02 no camarão que passou
vinte e quatro horas a temperatura ambiente (C24), os valores encontrados nas
amostras que foram submetidas ao congelamento por uma semana (CS1), por duas
semanas (CS2), por três semanas (CS3) e por quatro semanas (CS4) apresentaram
valores abaixo do limite de quantificação, Figura 2.
A espermidina foi detectada no camarão fresco, porém a partir dos resultados
obtidos foi possível verificar diminuição nos níveis de espermidinaque ocorreu
durante o processo de congelamento da amostra (BRINK et al., 1990).
Observou-se que após o cozimento a amostra apresentou concentrações de
espermidina abaixo do verificado para a amostra de camarão fresco.
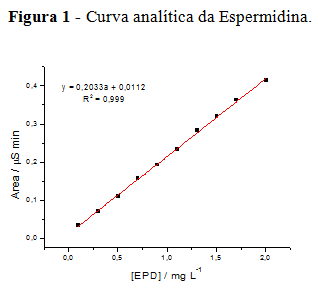
Curva analítica da Espermidina.
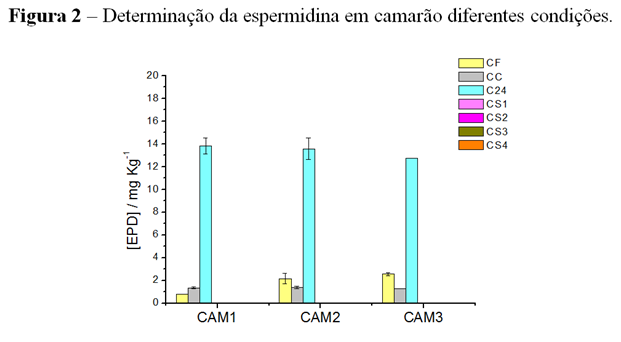
Determinação da Espermidina em camarão diferentes condições.
Conclusões
A partir dos resultados obtidos pode-se concluir que a espermidina pode ser utilizada como um indicador de qualidade do camarão visto que sua concentração diminui ao longo do tempo em que foi estudada.
Agradecimentos
Referências
Brasil. Ministerio da Agricultura Pecuaria e Abastecimento. Manual de garantia da qualidade analitica. / Ministerio da Agricultura Pecuaria e Abastecimento. Secretaria de Defesa Agropecuaria. – Brasilia : MAPA/ACS, 2011. Disponível em: <http://bibliotecaquimicaufmg2010.files.wordpress.com/2012/02/mapa-2011-manual-de-garantia-da-qualidade-analitica.pdf >. Acessoem: 20 ago. 2013.
BUENO-SOLANO, C.; LÓPEZ-CERVANTES, J.; SÁNCHEZ-MACHADO, D. I.
CAMPAS-BAYPOLI, O. N., HPLC DeterminationofHistamine, TyramineandAmino
Acids in ShrimpBy-Products. J. Braz. Chem. Soc. v. 23, n. 1, 2012.
HALÁSZ, A.; BARÁTH, A.; SIMON-SARKADI, L.; HOLZAPFEL, W. Biogenic
aminesandtheirproductionbymicroorganisms in food. TrendsFoodSciTechnolv.
5, p. 42–49, 1994.
Disponível em: <http://ac.els-cdn.com/0924224494900701/1-s2.0-0924224494900701-
main.pdf?_tid=b982c67a-d545-11e3-a38c-
00000aacb360&acdnat=1399398299_264d2f6f404dcecc32674b023979f2e0>. Acesso
em: 06 maio 2013.
LATORRE-MORATELLA, M. L., Bosch-Fuste, J., Lavizzari, T., Bover-Cid, S., Veciana-Nogues, M. T., & Vidal-Carou, M. C. Validation of an ultra high pressure liquid chromatographic method for the determination of biologically active amines in food.Journal of Chromatography A, v. 1216, n. 45, p. 7715–7720, 2009.
MAGA, A. Amines in foods. CRC CritRevFoodSci Nutr. V. 10, p. 373–399, 1978.
MADRID, R. M. M.; Influência do Meio Ambiente em Áreas de Risco na Qualidade Bacteriológica do Camarão Cultivado no Estado do Ceará. UNIVERSIDADE FEDERAL DO CEARÁ – UFC, INSTITUTO DE CIENCIAS DO MAR – LABOMAR. 2004.
MORET, S.; CONTE, L.S. High performance liquid chromatographic evaluation of biogenic amines in foods: an analysis of different methods of sample preparation in relation to food characteristics. Journal of Chromatography A, v. 729, p. 363- 369, 1996.Disponívelem: <http://ac.els-cdn.com/0021967395009612/1-s2.0-0021967395009612-main.pdf?_tid=b32c1c80-10ac-11e3-879d-00000aab0f6c&acdnat=1377782147_549efdf625355ccfa0f8060612823d36 >. Acessoem: 20 ago. 2013.
MONTEIRO, M. L. G. CONTE JÚNIOR, C. A., VITAL, H. C. Validade comercial de
filés de Tilápia do Nilo (Oreochromisniloticus) resfriados embalados em atmosfera
modificada e irradiados. Dissertação (Mestrado em Medicina Veterinária).
Universidade Federal Fluminense. Niterói – Rio de Janeiro, 2011 Disponível em:
<http://www.uff.br/higiene_veterinaria/teses/M_maria_lucia_guerra.pdf> acessado em:
01 de mar. 2014>
SMITH, T.A. Amines in food. FoodChemv. 6, p. 169–200, 1980–1981.










