ISBN 978-85-85905-10-1
Área
Bioquímica e Biotecnologia
Autores
Ramos, V. (UFLA) ; Silva, W.S. (CARE) ; Bertelli, M. (CARE SYSTEMS SOLUÇÕES BIO-AMBIENTAIS)
Resumo
Enzimas já são amplamente utilizadas em diversos processos industriais e de pesquisa e inovação. Neste trabalho os objetivos foram quantificar a atividade das enzimas produzidas por 5 cepas dos gêneros Cladosporium; Penicillium e Aspergillus da Micoteca da empresa Care Systems Soluções Bio-Ambientais e purificar parcialmente 5 enzimas. Foram realizados ensaios de atividade enzimática para amilase, celulase, pectinase, protease e lipase nos extratos brutos e nas frações precipitadas por adição de sulfato de amônio a 20, 40 e 60% de saturação. Todos os extratos brutos apresentaram atividade enzimática. Os resultados obtidos na precipitação parcial das enzimas com melhor resposta foram: amilase – 20%; celulase – 20 e 60%; pectinase – 60%; protease – 60% e lipase – 20% de saturação de sulfato
Palavras chaves
Precipitação; Sulfato de amônio; Atividade enzimática
Introdução
O uso de enzimas em produtos utilizados na farmacêutica, limpeza, aditivos alimentares, cosmética, tratamento de água e degradação de resíduos já é bem fundamentado. (HASAN, SHAH e HAMEED, 2006) As hidrolases, enzimas cuja principal característica é a quebra de polímeros naturais como amido, celulose, pectina, proteína assim como moléculas mais simples como os triacilgliceróis, tem importante papel no tratamento de resíduos contendo estes compostos. Outra aplicação comum é seu uso na indústria alimentícia para aumento da digestibilidade de matérias primas. Por se tratarem de catalisadores eficazes, específicos quanto ao alvo, ativos em temperaturas consideradas baixas para que as reações ocorram e principalmente por serem biodegradáveis, seu uso é ideal em tratamento de águas residuárias e na indústria alimentícia. A empresa Care Systems Soluções Bio Ambientais produz e comercializa enzimas com resultados confirmados em campo a partir de cepas oriundas da Micoteca da Empresa, onde atualmente são cultivados mais de 1000 espécies de diversos gêneros de fungos produtores de enzimas. Contudo, a presença destas enzimas ainda não havia sido confirmada através de ensaios enzimáticos. Neste trabalho objetivou-se confirmar a atividade enzimática de 5 extratos brutos produzidos pela Empresa Care Systems Soluções Bio-Ambientais, assim como iniciar o processo de purificação destas através da precipitação diferencial com sulfato de amônio.
Material e métodos
Dentre as várias espécies presentes na Micoteca da Empresa Care Systems Soluções Bio-Ambientais foram selecionadas 5 cepas dos seguintes gêneros: Cladosporium; Penicillium e Aspergillus, sendo cultivadas em meio BDA (batata, dextrose, ágar) (SMITH D, ONIONS A.H.S. 1983), e inoculados em biorreatores com meio indutor patenteado (BERTELLI, CHALFOUN DE SOUZA e PEREIRA). Após a fermentação sob agitação constante, os extratos enzimáticos selecionados foram: Amilase, Celulase, Lipase, Pectinase e Protease, os quais foram filtrados, à fração líquida (extrato bruto) foi adicionado sulfato de amônio (SA) nas concentrações de 20, 40 e 60% (m/v), permanecendo sob agitação orbital a 4°C por 30 min e mantida sob repouso à 4°C por 30 min até sua centrifugação. Os sobrenadantes foram descartados e os precipitados foram ressuspendidos em água na proporção 1/20 (m/v), sua atividade enzimática foi medida e comparada com a atividade do extrato bruto considerado como atividade a 100%. As atividades foram determinadas cineticamente em quatro tempos de reação (30, 60, 90 e 120 min) à 40°C. Amilase, pectinas e celulase tiveram seus produtos de reação (açúcares redutores) quantificados pelo método do DNS (MILLER, 1959) utilizando-se curva padrão de glicose variando de 0 a 2 mmol. Protease teve sua atividade quantificada segundo (TOMARELLI, CHARNEY e HARDING, 1949), com modificações, utilizando azocaseína como substrato. Lipase foi quantificada segundo Souza et al. (2011).
Resultado e discussão
Todos os meios de indução (extrato bruto) utilizados pela empresa como fonte de
enzimas produziram atividade enzimática nos ensaios de atividade. A atividade
encontrada por Yu e Hang, (1991) em amilase no gênero Rhizopus foi de
4473 U para o extrato bruto e 1828 U após precipitação por 50-70% de SA, uma
recuperação de 40,9%. Jabasingh, Varma e Garre, (2014) recuperaram 64,55% da
atividade de celulase no gênero Aspergillus, com atividade no extrato
bruto de 907,89 U e 586,09 U no precipitado com 80% de SA. A atividade
encontrada por Pedrolli e Carmona, (2010) em pectinase no gênero Aspergillus
foi de 478,8 U e no sobrenadante a 70% de SA 219,37 U, recuperação de 46%.
Papagianni e Sergelidis, (2014) purificaram uma nova protease no gênero
Penicillium com 6600 U no extrato bruto e 6570 U no precipitado a 80% de
SA, recuperação de 99,54%. A lipase obtida de Bacillus smithii por
Lailaja e Chandrasekaran, (2013) apresentou atividade no extrato bruto de 158,33
U e a precipitada por SA a 80% de saturação 3,42 U, uma recuperação de 2,16 %.
Os resultados obtidos (Tabela 1) são condizentes com a literatura, indicando que
o procedimento adotado foi eficaz na purificação parcial das enzimas produzidas
pela empresa Care Systems Soluções Bio Ambientais. As condições de precipitação
com melhor resposta foram: amilase – 20%; celulase – 20 e 60%; pectinase – 60%;
protease – 60% e lipase – 20% de saturação de SA.
Lipase apresenta perda de recuperação com concentrações crescentes de SA,
indicando ser uma enzima com alto peso molecular (PM) e sensível à força iônica.
Aparentemente há a presença de duas ou mais celulases, de baixo e de alto PM,
resultado idêntico para pectinase. Protease indica fortemente ser uma enzima de
baixo PM.
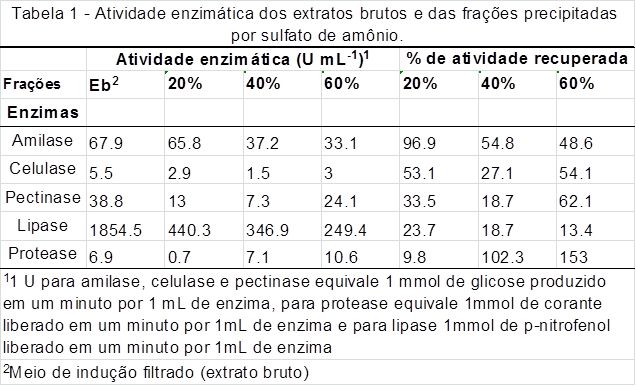
Atividade enzimática dos extratos brutos e das frações precipitadas por sulfato de amônio.
Conclusões
O uso dos gêneros Cladosporium; Penicillium e Aspergillus se provou eficaz na produção de enzimas para uso industrial. O fracionamento com sulfato de amônio permitiu inferir o tamanho das enzimas, assim como fornecer um método para redução do volume do extrato, resultado interessante em termos comerciais. Lipase não apresentou boa recuperação de atividade, o que exige novas investigações a respeito das propriedades e formas de purificação desta enzima.
Agradecimentos
Agradeço a Care Systems Soluções Bio-Ambientais e a UFLA
Referências
BERTELLI, M. A.; CHALFOUN DE SOUZA, S. M.; PEREIRA, M. C. Method for using fungi for treating domestic and industrial wastewater, involves isolating Cladosporium cladosporioides SIY 001 strain as a source of cellulose and protease and Penicillium crustosum as source of amylase: CARE SYSTEMS COM E REP PROD AGROP LTDA.
HASAN, F.; SHAH, A. A.; HAMEED, A. Industrial applications of microbial lipases. Enzyme and Microbial Technology, v. 39, n. 2, p. 235-251, 2006.
JABASINGH, S. A.; VARMA, S.; GARRE, P. Production and Purification of Cellulase from Aspergillus nidulans AJSU04 under Solid-state Fermentation using Coir Pith. Chemical and Biochemical Engineering Quarterly, v. 28, n. 1, p. 143-151, 2014.
LAILAJA, V. P.; CHANDRASEKARAN, M. Detergent compatible alkaline lipase produced by marine Bacillus smithii BTMS 11. World Journal of Microbiology & Biotechnology, v. 29, n. 8, p. 1349-1360, 2013.
MILLER, G. L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, v. 31, n. 3, p. 426-428, 1959.
PAPAGIANNI, M.; SERGELIDIS, D. Purification and Biochemical Characterization of a Novel Alkaline Protease Produced by Penicillium nalgiovense. Applied Biochemistry and Biotechnology, v. 172, n. 8, p. 3926-3938, 2014.
PEDROLLI, D. B.; CARMONA, E. C. Purification and characterization of the exopolygalacturonase produced by Aspergillus giganteus in submerged cultures. Journal of Industrial Microbiology & Biotechnology, v. 37, n. 6, p. 567-573, 2010.
TOMARELLI, R. M.; CHARNEY, J.; HARDING, M. L. THE USE OF AZOALBUMIN AS A SUBSTRATE IN THE COLORIMETRIC DETERMINATION OF PEPTIC AND TRYPTIC ACTIVITY. Journal of Laboratory and Clinical Medicine, v. 34, n. 3, p. 428-433, 1949.
SOUZA, S. P. et al. Inhibition of pancreatic lipase by extracts of Baccharis trimera: evaluation of antinutrients and effect on glycosidases. Revista Brasileira De Farmacognosia-Brazilian Journal of Pharmacognosy, v. 21, n. 3, p. 450-455, 2011.
YU, R. C.; HANG, Y. D. PURIFICATION AND CHARACTERIZATION OF A GLUCOAMYLASE FROM RHIZOPUS-ORYZAE. Food Chemistry, v. 40, n. 3, p. 301-308, 1991.










