ISBN 978-85-85905-10-1
Área
Bioquímica e Biotecnologia
Autores
Silva, W. (UFLA) ; Ramos, V. (CARE SYSTEMS SOLUÇÕES BIO AMBIENTAIS LTDA.) ; Bertelli, M. (CARE SYSTEMS SOLUÇÕES BIO AMBIENTAIS LTDA.) ; Mendes, R. (RINEN CHEMICAL GROUP)
Resumo
A utilização de micro-organismos como produtores de enzimas, vem sendo amplamente utilizado em diversos processos industriais. Neste Trabalho, objetivou-se identificar micro-organismos com potencial para produção de xilanase utilizando-se bagaço de cana-de-açúcar como substrato, bem como avaliar a eficiência de dois meios indutores, um proposto por Ferreira (1999) e outro patenteado da empresa Care Systems Soluções Bio Ambientais. Os melhores resultados foram com Aspergillus spp. em meio indutor de Ferreira (1999) e Penicillium spp. em meio indutor patenteado da empresa Care Systems Soluções Bio Ambientais.
Palavras chaves
Aspergillus spp.; Penicillium spp.; Mortirella spp.
Introdução
Dentre as hemiceluloses, a xilana é a segunda mais abundante na madeira e resíduos agrícolas (PRADE, 1995), composta por ligações β-1,4 de resíduos de D- xilanopiranosil com ramificações arabinosil e/ou acetil, variando de acordo com o vegetal (WONG et al., 1988; HALTRICH et al., 1996). Xilanases são β-glucanases que hidrolisam xilana. O sistema de degradação da xilana inclui, especialmente, β-1,4-D-xilanases e β-D-xilosidase, além de enzimas acessórias que removem as ramificações da cadeia de xilano como α- arabinofuranosidase, acetilxilano esterase, α-D-glucuronidase, ácido ferrúlico esterase e ácido ρ-coumárico Esterase. (PRADE, 1995; ZANOELO et al., 2004; POLIZELI et al., 2005; BEG et al., 2001; DEKKER, 1983) Os fungos em função de suas características de reprodução e crescimento, além de sua grande capacidade de se adaptarem aos mais variados substratos, são a fonte mais comum de xilanases. (DEKKER, 1979, BISARIA e GHOSE, 1981). O grande interesse pelas enzimas xilanases está relacionado com suas mais variadas aplicações na indústria: como nos processos de clareamento de polpa de papel, recuperação de fibras celulósicas têxteis e bioconversão da biomassa em combustíveis e substâncias químicas (PRADE, 1995), na panificação, (CAMACHO e AGUIAR, 2003), além da fabricação de cerveja (RIZZATTI, 2004), dentre outras. Sendo assim, o objetivo deste trabalho foi identificar micro-organismos com potencial para produção de xilanase utilizando-se bagaço de cana-de-açúcar, bem como avaliar a eficiência do meio indutor patenteado da empresa Care Systems Soluções Bio Ambientais.
Material e métodos
Empregou-se para produção enzimática dois meios indutores: um utilizado por Ferreira (1999) e o outro, um meio indutor patenteado (BERTELLI, CHALFOUN DE SOUZA E PEREIRA). Como fonte de carbono foi utilizada bagaço de cana-de-açúcar a 2% (m/v) sendo secas à temperatura ambiente, moídas e peneiradas a 1 mm e juntamente com o meio autoclavada a 0,5 atm por 30 minutos. Dentre as várias espécies presentes na Micoteca da Empresa Care Systems Soluções Bio Ambientais foram selecionadas linhagens dos gêneros Penicillium; Aspergillus e Mortierella, cultivadas em meio BDA (batata, dextrose, ágar) (SMITH D, ONIONS A.H.S. 1983). A concentração de esporos foi ajustada para 107 esporos/ml, sendo o inóculo realizado colocando-se 1ml da solução de esporos em erlenmeyers de 250 ml, contendo 50 ml dos diferentes substratos. Os erlenmeyers foram mantidos em agitação de 150 rpm, a 25ºC por 96 horas. Após as 96 horas de agitação, foi determinado cineticamente a atividade dos extratos em quatro tempos de reação (30, 60, 90 e 120 min) à 40°C com triplicatas em cada tempo reacional. A atividade de xilanase foi avaliada segundo BAILEY et al. (1992), usando-se xilana de faia como substrato e seus produtos de reação (açúcares redutores) quantificados pelo método do DNS (MILLER, 1959) utilizando-se curva padrão de glicose variando de 0 a 2mmol.
Resultado e discussão
Ao analisar a atividade enzimática dos três micro-organismos nos dois meios
indutores, constatou-se que a produção de xilanase através de Aspergillus
spp., utilizando o meio de Ferreira (1999), obteve maior atividade, 156,9267
U/L)
Porém os resultados obtidos nos três gêneros de micro-organismos utilizando-se o
meio indutor patenteado (BERTELLI, CHALFOUN DE SOUZA E PEREIRA) foram mais
satisfatórios e eficientes se comparados aos mesmos gêneros de micro-organismos
utilizando o meio de Ferreira (1999).
Aparentemente, as diferenças entre os resultados obtidos na produção de xilanase
por Aspergillus spp. no meio indutor de Ferreira (1999) e
Penicillium spp. no meio indutor patenteado (BERTELLI, CHALFOUN DE SOUZA
E PEREIRA) são pequenas.
Os micro-organismos utilizados foram capazes de produzir o complexo xilanase a
partir de bagaço de cana conforme Menezes et al. (2009) e Aguiar e Menezes
(2000), fonte de carbono abundante e barata no Brasil.
Na Tabela 1 são apresentadas as atividades de cada micro-organismo para os
diferentes meios indutores.
A parcial remoção da lignina facilita a produção de enzimas pelos micro-
organismos, pois aumentaria a concentração de celulose, indutora de celulases
(Aguiar e Menezes, 2000). Desta forma, autoclavando o bagaço de cana-de-açúcar,
podemos facilitar este processo aos micro-organismos produtores de celulase.
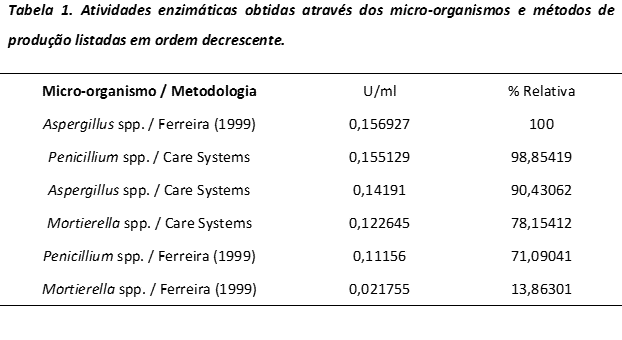
Tabela 1. Atividades enzimáticas obtidas através dos micro-organismos e métodos de produção listadas em ordem decrescente.
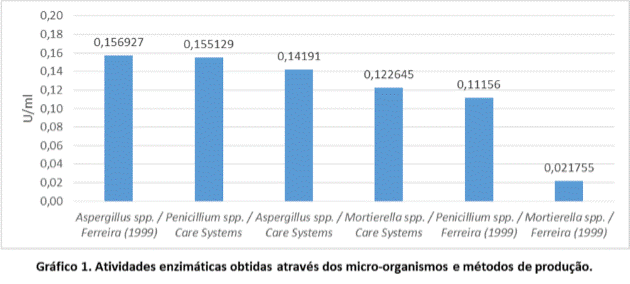
Gráfico 1. Atividades enzimáticas obtidas através dos micro-organismos e métodos de produção.
Conclusões
Todos os fungos utilizados produziram xilanase. Os gêneros que mais produziram foram Aspergillus spp. em meio Ferreira e Penicillium spp. no meio Care Systems. O meio patenteado pela empresa Care Systems Soluções Bio Ambientais, apresentou-se mais eficiente pois conseguiu obter resultados mais significativos de atividades que o meio indutor de Ferreira (1999).
Agradecimentos
Agradeço a Empresa Care Systems Soluções Bio Ambientais Ltda e a UFLA.
Referências
AGUIAR, C.L e MENEZES, T.J.B. PRODUÇÃO DE CELULASES E XILANASE POR Aspergillus niger IZ9 USANDO FERMENTAÇÃO SUBMERSA SOBRE BAGAÇO DE CANA-DE-AÇÚCAR. B.CEPPA, v. 18, n. 1, p. 5770.2000.
BAILEY, M.J.; BIELY, P.; POUTANEN, K. Interlaboratory testing of methods for assay of xylanase activity. Journal of Biotechnology, v. 23, n. 3, p. 257-270, 1992.
BEG, Q.K.; KAPOOR, M.; MAHAJAN, L.; HOONDAL, G.S. Microbial xylanases and their industrial applications: a review. Applied Microbiology and Biotechnology, v. 56, p.326-338, 2001.
BERTELLI, M. A.; CHALFOUN DE SOUZA, S. M.; PEREIRA, M. C. Method for using fungi for treating domestic and industrial wastewater, involves isolating Cladosporium cladosporioides SIY 001 strain as a source of cellulose and protease and Penicillium crustosum as source of amylase: CARE SYSTEMS COM E REP PROD AGROP LTDA.
BISARIA, V.S.; GHOSE, T.K. Biodegradation of cellulosic material: substrates, microorganisms, enzyme and products. Enzyme and Microbial Technology, v. 3, n. 2, p. 90-104. 1981.
CAMACHO, N.A.; AGUIAR O.G. Production, purification and characterization of a low molecular mass xylanase from Aspergillus sp and it is application in bakery. Applied Biochemistry and Biotechnology, v.104, p.159-172, 2003.
DEKKER, R.F.H. Bioconversion of hemicellulose: aspects of hemicellulase production by Trichoderma reesei QM 9414 and enzymic sacharification of hemicellulose. Biotechnology and Bioengineering, v. 25, n. 4, p. 1127-1146, 1983.
DEKKER, R.F.H. The hemicellulase group of enzymes. In: BLANSHARD, J.M.V.; MITCHEL, J.R. (Ed.). Polyssacarides in food, p. 93-108. 1979.
FERREIRA, M.H. Atividade xilanolítica de Penicillium griseoroseum cultivado em resíduo lignocilulósico. 1998. 52p. Dissertação (Mestrado em Microbiologia Agrícola) – Universidade Federal de Viçosa, Viçosa, 1999.
HALTRICH, D.; NIDETZKY, B.; KULBE, K.D.; STEINER, W.; ZUPANCIC, S. Production of fungal xylanases. Bioresource Technology, 58: 137 – 161, 1996.
MENEZES, C.R; SILVA, I.S e DURRAN, L.R. Bagaço de cana: fonte para produção de enzimas lignocelulolíticas. Estudos Tecnológicos - Vol. 5, n° 1:68-78. 2009
MILLER, G. L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, v. 31, n. 3, p. 426 — 428, 1959.
POLIZELI, M.L.T.M.; RIZZATI, A.C.S.; MONTI, R.; TERENZI, H.F.; JORGE, J.A.; AMORIM, D. S. Xylanases from fungi: properties and industrial applications. Applied Microbiology Biotechnology, v. 67, p. 577-591, 2005.
PRADE, R. Xylanases: from biology and biotechnology. Biotechnology & Genetic Engineering Reviews, v. 13, p. 101-131, 1995.
RIZZATTI, A.C.S.; SANDRIM, V.C.; JORGE, J.A.; TERENZI, H.F.; POLIZELI, M. L.T.M. Influence of temperature on the properties of the xilanolytic enzymes of the thermo tolerant fungus Aspergillus phoenicis. Journal of Industrial Microbiology and Biotechnology, v.31 p. 88-93, 2004.
WONG, K. K. Y.; TAN, L. U.; SADDLER, J. N. Multiplicity of β-1,4-xylanases in microorganisms: functions and applications. Microbiological Reviews, v. 52, n. 3, p. 305-317. 1988.
ZANOELO, F.F.; POLIZELI, M.L.T.M,; TERENZI, H.F.; JORGE, J.A. Purification and biochemical properties of a thermostable xyloside-tolerant -d-xylosidade from Scytalidium thermophilum. Journal of Industrial Microbiology and Biotechnology, v. 31, n. 4, p.170-176, 2004.










