ISBN 978-85-85905-10-1
Área
Bioquímica e Biotecnologia
Autores
Sousa Junior, F.C. (UFRN) ; Vaz, M.R.F. (UFCG) ; Silva, V.N. (UFRN) ; Chibério, A.S. (UFRN) ; Ribeiro, V.T. (UFRN) ; Martins, D.R.A. (UFRN) ; Santos, E.S. (UFRN) ; Macedo, G.R. (UFRN)
Resumo
O presente trabalho teve como objetivo estudar o efeito de duas estratégias de indução (pulso e adição gradual) com IPTG na expressão do antígeno 503 de Leishmania infatum chagasi em E. coli. No ensaio em batelada (pulso), o IPTG foi adicionado ao cultivo na concentração final de 1,0 mM. Na batelada alimentada (adição gradual), 0,2 mM do indutor foi adicionado a cada hora, totalizando uma concentração de 0,8 mM. O procedimento de indução por adição gradual de IPTG indicou um incremento de 3 vezes na produção do antígeno 503 quando comparado à indução em batelada. Pode-se concluir que a estratégia de indução por batelada alimentada foi mais eficaz na expressão da proteína quando comparada à estratégia de batelada simples. A eficácia da estratégia de indução foi confirmada por eletreforese.
Palavras chaves
Indução; IPTG; Leishmaniose
Introdução
A Leishmaniose é uma doença causada por protozoários do gênero Leishmania, que de acordo com a espécie podem produzir manifestações cutâneas, mucocutâneas, cutâneas difusas e viscerais (ETTINGER et al., 2009). A doença possui uma ampla distribuição, principalmente, em regiões tropicais e subtropicais. Estima-se que existam em todo o mundo 12 milhões de pessoas infectadas com as diversas formas da doença, e cerca de 350 milhões de pessoas expostas ao risco de infecção (DAVIES et al., 2003). Devido ao elevado custo e toxicidade das drogas utilizadas na cura da leishmaniose, a busca de alternativas eficazes e menos invasivas ao organismo humano torna-se imprescindível (SELVAPANDIYAN et al., 2012). A expressão de genes em linhagens de E. coli geralmente necessita de indução, podendo ser realizada por compostos como o Isopropil-1-tio-β-D- galactopiranosídio (IPTG), um indutor equivalente à lactose largamente utilizado nos processos em que estão envolvidos a indução de promotores (PANDA et al., 1999). Estudos relatam que a estratégia de indução é um parâmetro importante na otimização da expressão de proteínas recombinantes. A maioria dos pesquisadores aperfeiçoaram a estratégia de indução variando a concentração do indutor (AUSTIN et al., 2004; VIDAL et al., 2005) e o instante de indução (HU et al., 2004), no entanto, existem poucos relatos na melhora do rendimento do produto, alterando o modo de adição de indutor, por exemplo, de modo descontínuo ou descontínuo alimentado (RAMÍREZ; BENTLEY 1995; STRIEDNER et al., 2003). Nesse contexto, o presente estudo teve como objetivo estudar o efeito de duas estratégias de indução com IPTG (batelada e batelada-alimentada) na expressão do antígeno 503 de Leishmania infatum chagasi expresso em E. coli.
Material e métodos
Microrganismo Utilizou-se uma cepa de E. coli geneticamente modificada para expressão do antígeno 503 de Leishmania i. chagasi (MARTINS et al., 2006). Esta construção foi gentilmente cedida por Mary Wilson (University of Iowa, USA). Cultivo em biorreator de bancada A cepa de E. coli foi cultivada em meio 2xTY (triptona 16,0 g/L, extrato de levedura 10,0 g/L, NaCl 5,0 g/L) suplementado com ampicilina (0,1 g/L) e kanamicina (0,025 g/L). Para preparo do inóculo, a cepa foi cultivada em incubador rotativo por 12 h a 200 rpm e 37°C. O cultivo foi realizado em biorreator de bancada Biostat B (B. Braun Biotech International) com volume de trabalho de 1,5 L, a 400 rpm, 37°C, aeração de 1,0 vvm e pH 7,0 ± 0,1 (VAZ et al., 2011). A indução foi realizada no início da fase exponencial de crescimento, quando a densidade óptica (OD 600nm) atingiu 0,5 (fase log). Duas estratégias de indução com IPTG (batelada e batelada alimentada) foram avaliadas. No ensaio em batelada, o IPTG foi adicionado ao cultivo na concentração final de 1 mM. Na batelada alimentada, 0,2 mM do indutor foi adicionado a cada hora durante 4 horas, totalizando uma concentração final de 0,8 mM de IPTG. Alíquotas foram coletadas a cada hora e submetidas à centrifugação (centrífuga Eppendorf 5415D) a 13.000 rpm por 30 minutos. As células foram submetidas a rompimento celular com tampão de uréia 8 M. Métodos Analíticos O crescimento celular foi mensurado de acordo com a absorbância do meio de cultura no comprimento de onda de 600 nm e por massa seca (g/L). A concentração de proteínas totais foi determinada pelo método de Lowry. A expressão de proteína de interesse foi analisada por SDS-PAGE.
Resultado e discussão
A Figura 1A apresenta o comportamento da curva de crescimento celular de E. coli
recombinante nas duas estratégias de indução estudadas. Para as duas estratégias
de indução pode-se observar ausência da fase lag, indicando uma rápida adaptação
da bactéria ao meio. Para a indução em batelada, a máxima concentração celular
obtida foi de 2,98 g/L após 5 horas de cultivo. Na estratégia de indução
empregando IPTG em batelada alimentada, obteve-se a máxima concentração celular
de 4,07 g/L às 6 horas do cultivo. Este resultado indica um incremento de
aproximadamente 136% na produção de biomassa quando comparado com o procedimento
de indução em batelada.
A Figura 1B mostra o perfil de expressão do antígeno 503 nas duas estratégias de
indução estudadas. Para a estratégia de indução em batelada, observou-se um pico
de produção da proteína (0,049 g/L) no instante de indução (1 h). Para a
estratégia em batelada alimentada, obteve-se uma concentração máxima de 0,168
g/L às 6 horas de cultivo. Pode-se observar um incremento de 3 vezes na
expressão da proteína quando comparado com a estratégia em batelada, sugerindo
que a forma de adição do indutor pode ser uma variável relevante para o processo
de síntese da proteína.
A Figura 2 apresenta a SDS-PAGE do antígeno 503 de Leishmania i. chagasi
durante o cultivo de E. coli recombinante induzido por adição gradual de IPTG
(batelada alimentada), em que pode-se observar a expressão da proteína de
interesse com massa molecular de aproximadamente 56 kDa.
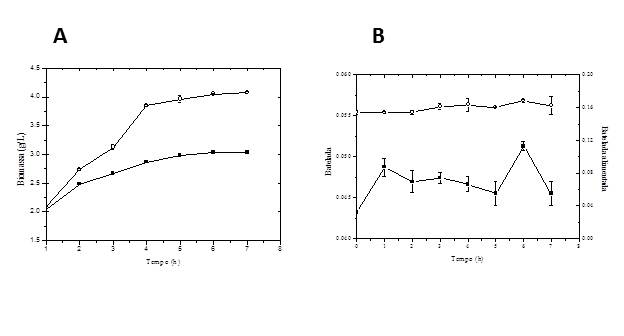
(A) Perfil de Biomassa e (B) Expressão do antígeno 503 em cultivos induzidos por IPTG em batelada (■) e batelada alimentada (○).
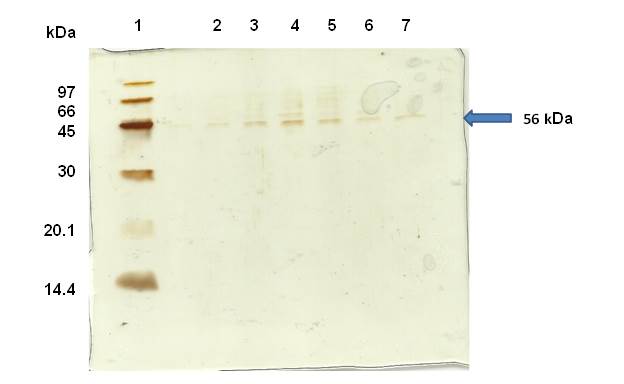
SDS-PAGE da expressão do antígeno 503 de Leishmania i. chagasi durante o cultivo E. coli induzido pela adição gradual de IPTG
Conclusões
Pode-se concluir que a estratégia de indução empregando pulsos de IPTG (batelada alimentada) adicionado em diferentes instantes ao longo do cultivo foi mais eficaz na expressão do antígeno 503 quando comparado à estratégia de batelada simples, em que todo o indutor é adicionado em um único instante, mesmo sendo a quantidade total de indutor adicionado em pulsos fracionados inferior à quantidade adicionada na estratégia de pulso único. A eficácia desta estratégia de indução é também confirmada pela visualização de bandas proteicas por eletreforese com massa molecular de aproximadamente 56 kDa.
Agradecimentos
Os autores agradecem ao CNPq, CAPES e PROPESQ/UFRN pelo auxílio financeiro e bolsas para realização do trabalho.
Referências
AUSTIN, C.J.D.; MIZDRAK, J.; MATIN, A.; SIRIJOVSKI, N.; KOSIM-SATYAPUTRA, P.; WILLOWS, R.D.; ROBERTS, T.H.; TRUSCOTT, R.J.W.; POLEKHINA, G.; PARKER, M.W.; JAMIE, J.F. Optimised expression and purification of recombinant human indoleamine 2,3-dioxygenase. Protein Expression and Purification, v. 37, n. 2, p. 392–398, 2004.
DAVIES, C.R.; KAYE, P.; CROFT, S.L.; SUNDAR, S. Leishmaniasis: new approaches to disease control. British Medical Journal, v. 326, n. p. 377-382, 2003.
ETTINGER, N.A.; DUGGAL, P.; BRAZ, R.F.; NASCIMENTO, E.T.; BEATY, T.H.; JERONIMO, S.M., PEARSON, R.D.; BLACKWELL, J.M., MORENO, L.; WILSON, M.E. Genetic admixture in Brazilians exposed to infection with Leishmania chagasi. Annals of Human Genetics, v. 73, n. 3, p. 304-313, 2009.
HU, S.Y.; WU, J.L.; HUANG, J.H. Production of tilapia insulin-like growth factor-2 in high cell density cultures of recombinant Escherichia coli, Journal of Biotechnology, v.107, n.2, p.161–171, 2004.
MARTINS, D.R.A.; JERONIMO, S.M.B.; DONELSON, J.E.; WILSON, M.E. Leishmania chagasi T Cell Antigens Identified Through a Double Library Screen. Infection and Immunity, v. 74, n. 12, p. 6940-6948, 2006.
PANDA, A. K.; KHAN, R. H.; RAO, K. B. C.; TOTEY, S.M. Kinetics of inclusion body production in batch and high cell density fed-batch culture of Escherichia coli expressing ovine growth hormone. Journal of Biotechnology, v.75, n. 2-3, p.161-172, 1999.
RAMÍREZ, D.M.; BENTLEY, W.E. Fed-batch feeding and induction policies that improve foreign protein synthesis and stability by avoiding stress responses. Biotechnology and Bioengineering, v. 47, n. 5, p. 596–608, 1995.
SELVAPANDIYAN, A.; DEY, R.; GANNAVARAM, S.; LAKHAL-NAOUAR, I; DUNCAN, R.; SALOTRA, R. NAKHASI, H. Immunity to Visceral Leishmaniasis Using Genetically Defined Live-Attenuated Parasites. Journal of Tropical Medicine, v.1, p.1-12, 2012.
STRIEDNER, G.; CSERJAN-PUSCHMANN, M.; POTSCHACHER, F.; BAYER, K. Tuning the transcription rate of recombinant protein in strong Escherichia coli expression systems through repressor titration. Biotechnology Progress, v.19, n. 5, p. 1427–1432, 2003.
VAZ M.R.F., FRANCA R.L.S., ANDRADE S.S.L., SOUSA JUNIOR F.C., SANTOS E.S., MARTINS D.R.A., MACEDO G.R. M. Influence of culture medium on the production of eif antigen from Leishmania chagasi in recombinant Escherichia coli. Brazilian Journal of Microbiology, v.42, n. 4, p.1390-1396, 2011.
VIDAL, L.; ÁLVARO, G.; BENAIGES, M. D.; CAMINAL, G. Influence of induction and operation mode on recombinant rhamnulose-phosphate aldolase production by Escherichia coli using the T5 promoter. Journal of Biotechnology, n.118, v.1, p. 75–87, 2005.










