ISBN 978-85-85905-10-1
Área
Bioquímica e Biotecnologia
Autores
Correia Bittarello, A. (UNESP) ; Cavecci, B. (UNESP) ; Cavalcante Souza Vieira, J. (UNESP) ; Pereira Braga, C. (UNESP) ; Queiroz, J.V. (UNESP) ; Federici Padilha, I. (UNESP) ; Federici Padilha, C. (UNESP) ; Magalhães Padilha, P. (UNESP)
Resumo
A contaminação por mercúrio tem sido reconhecida como uma questão importante desde o início da década de 1970, e hoje há abundância de evidências de que este metal é um dos mais tóxicos para os organismos vivos. A principal via de absorção pelos peixes é dietética e representa uma ligação importante entre a contaminação por mercúrio e a saúde humana. O mercúrio afeta principalmente: fígado, mucosa intestinal, rins, músculo, sangue e sistema nervoso. O mercúrio em sua forma orgânica (metilada) se liga a proteínas, e estudos mostram que essa afinidade ocorre com proteínas de baixo peso molecular. Este trabalho buscou através de técnicas de separação proteica (2D-PAGE) e de quantificação de mercúrio (GFAAS) iniciar os estudos para a busca de um potencial biomarcador de toxicidade de mercúrio.
Palavras chaves
2D-PAGE; GFAAS; Contaminação
Introdução
A distribuição do mercúrio nos sedimentos está relacionada com o conteúdo de carbono orgânico, argila, ferro, fósforo, potencial redox e enxofre, dentre outros. Os agentes orgânicos complexantes solúveis em água, tais como humatos e fulvatos, podem quelar as cinco espécies solúveis e insolúveis na água; os últimos precipitam-se diretamente da solução para o sedimento. Os solos possuem elevada capacidade de reter e armazenar mercúrio, devido ao forte acoplamento deste com o carbono presente. Os solos argilosos apresentam, aparentemente, grande capacidade de reter mercúrio, podendo acumulá-lo por muitos anos. Como o curimatã é uma espécie detritívora, que se alimenta dos sedimentos, o objetivo deste estudo foi compreender a relação do mercúrio e sua ligação com as proteínas desta espécie (BAHIA, 1997; ROCHA et al., 2000; PFEIFFER et. al., 1993; MALM et al., 1995; LECHLER et al., 1997).
Material e métodos
Em almofariz, 1g de pool de tecido muscular, foi macerado (pistilo) com água deionizada (1:1), as proteínas extraídas foram separadas por precipitação fracionada com misturas de etanol/clorofórmio e etanol/ácido clorídrico. A determinação de proteína total foi feita através do método de Biureto. Após esses procedimentos, os pellets proteicos foram ressolubilizados em tampão específico e submetidos ao processo de separação por eletroforese bidimensional em gel de poliacrilamida com concentração de 15% (2D–PAGE). Os spots de massa molar inferior a 30 kDa foram recortados e mineralizados com ácido sulfúrico e peróxido de hidrogênio e o Hg quantificado através de técnica de espectrometria de absorção atômica em forno de grafite (GFAAS) (MORAES et al., 2013).
Resultado e discussão
A Figura 1 mostra um dos géis obtido em seis repetições das corridas
eletroforéticas das amostras de tecido muscular (Os números e círculos em
vermelho indicam os spots nos quais foram identificadas a presença de mercúrio).
Os spots proteicos destacados com círculo são aqueles nos quais foi detectada a
presença de mercúrio e suas concentrações por GFAAS.
Foi feita a conversão da estimativa das massas de spots proteicos e das massas
de mercúrio para quantidade de moléculas de spot proteico e quantidade de átomos
de mercúrio. Para isso, consideraram-se as respectivas massas molares dos spots
proteicos, a massa molar do mercúrio (200,59 g mol-1), a constante de Avogadro
(6,022x1023) e que 1 kDa = 1,661x10-24 g. Esses cálculos possibilitaram a
estimativa de quantos átomos de mercúrio estariam presentes por moléculas de
spot proteico (LIMA et al., 2010; SANTOS et al., 2011; NEVES et al., 2012). Os
resultados obtidos nesses cálculos são mostrados na tabela 1 em termos de número
de átomos mercúrio por molécula do spot proteico considerado.
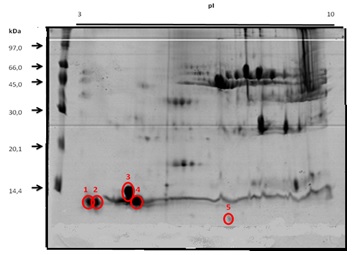
Gel a 15% (m/v) obtido por 2D-PAGE (faixa de pH 3- 10) para amostras de tecido muscular de curimatã.
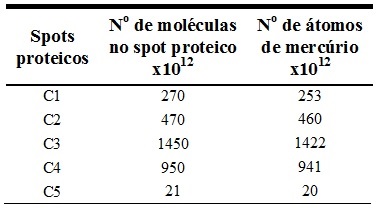
Estimativa do número de átomos de mercúrio por molécula de spot proteico das amostras de tecido muscular de curimatã.
Conclusões
Para o estudo inicial da metalômica, esses resultados são relevantes, pois permitirão futuramente, com auxílio de outras metodologias, afirmar quais destas proteínas são metaloproteínas, e quais destas são possíveis biomarcadoras de toxicidade de mercúrio.
Agradecimentos
À Capes, FAPESP 2010/51332-5, ANEEL/ESBR PD-6631-0001/2012 e CNPq 472388/2011-8.
Referências
BAHIA, M. O. Le potentiel génotoxique du mercure: mutations HPRT et effects cytogénétiques. Dissertação de Mestrado, Montreal - Canadá: Université du Quebéc à Montréal, 119p., 1997.
LECHLER, P. L.; MILLER, J.; WARWICK, J.; LYONS, B. Mercury concentrations in channel bed sediments floodplain sediments, and lateric soils of the Madeira river basin, Brazil: Implications for anthropogenic versus natural sources. EOS, Transactions, American geophysical Union, fall meeting, v.78, p.846, 1997.
LIMA, P. M., NEVES, R. C. F., SANTOS, F. A., PEREZ, C. A., DA SILVA, M. A. O., ARRUDA, M. A. Z., CASTRO, G. R., PADILHA P. M. Analytical approach to the metallomic of Nile tilapia (Oreochromis niloticus) liver tissue by SR XRF and FAAS after 2D PAGE separation: Preliminary results. Talanta, 82: 052-1056, 2010.
MALM, O.; CASTRO, M. B.; BASTOS, W. R.; BRANCHES, F. J. P.; GUIMARÃES, J. R. D.; ZUFFO, C. E.; PFEIFFER, W. C. An assessment of Hg pollution in different goldmining areas, Amazon Brazil. The Science of the total environment, 175(2): 127-140, 1995.
MORAES, P. M.; SANTOS, F. A.; CAVECCI, B.; PADILHA, C. C. F.; VIEIRA, J. C. S.; ROLDAN, P. S.; PADILHA, P. M. GFAAS determination of mercury in muscle samples of fish from Amazon, Brazil. Food Chemistry, 141: 2614-2617, 2013.
NEVES, R. C. F.; LIMA, P. M.; BALDASSINI, W. A.; SANTOS, F. A.; MORAES, P. M.;CASTRO, G. R.; PADILHA P. M. Fracionamento de cobre em proteínas do plasma, músculo e fígado de tilápia do Nilo. Química Nova, 35: 493-498, 2012.
PFEIFFER, W. C.; LACERDA, L. D.; SALOMONS, W.; MALM, O. Environment fate of mercury from gold mining in the Brazilian Amazon. Environmental Reviews, 1: 26-37, 1993.
ROCHA, J. C.; SARGENTINI JUNIOR, É.; ZARA, L. F.; ROSA, A. H.; SANTOS, A.; BURBA, P. Reduction of mercury(II) by tropical river humic substances (Rio Negro) - A possible process of the mercury cycle in Brazil. Talanta, 53(3): 551-559, 2000.
SANTOS, F. A., LIMA, P. M., NEVES, R. C. F., MORAES, P. M., PEREZ, C. A, DA SILVA, M. A. O., ARRUDA, M. A. Z., CASTRO, G. R., PADILHA, P. M. Metallomic study of plasma samples from Nile tilapia using SR-XRF and GFAAS after separation by 2D PAGE: initial results. Microchimica Acta, 173: 43-49, 2011.










