ISBN 978-85-85905-10-1
Área
Bioquímica e Biotecnologia
Autores
Cavecci, B. (IBB UNESP) ; C. S. Vieira, J. (IBB UNESP) ; P. Braga, C. (IBB UNESP) ; V. Queiroz, J. (FMVZ UNESP) ; C. Bitarello, A. (FMVZ UNESP) ; F. Padilha, I. (IBILCE UNESP) ; C. F. Padilha, C. (IBB UNESP) ; M. Padilha, P. (IBB UNESP)
Resumo
A poluição química e biológica dos rios amazônicos configura um dos principais problemas socioambientais da Amazônia. A contaminação pelo mercúrio marcou a Amazônia nas décadas de 80 e 90, volta a discussão. Dentre as espécies consumidas nessa região, aquelas de hábitos alimentares carnívoros como a Dourada (Brachyplatystoma rousseauxii) são as mais nocivas para a população, por ocuparem um nível trófico mais elevado na cadeia alimentar. Baseado nesse contexto o objetivo desse trabalho foi o de realizar separações eletroforéticas (2D-PAGE) e quantificar o mercúrio presente nos spots proteicos utilizando espectrometria de absorção atômica com forno de grafite (GFAAS). Com essas técnicas estimou-se a proporção de átomos de mercúrio por molécula de spot proteico.
Palavras chaves
Metalômica; Mercúrio; Peixe
Introdução
O pescado é importante fonte de proteínas de alto valor biológico, vitaminas e minerais. Investigação recente mostra a importância do pescado como fonte de ácidos graxos e ômega-3 benéficos ao sistema cardiovascular e o desenvolvimento fetal. Recomendações dietéticas aconselham o consumo semanal de peixe. Porém, este é a principal via dietética de exposição a contaminantes como o mercúrio (Valle, B. L. 1999). A população de regiões afetadas pelas atividades mineradoras na bacia do Amazonas tem dieta à base de peixes, com consumo de cerca de 200 g de peixe por dia. Dentre as espécies consumidas nessa região, aquelas de hábitos alimentares carnívoros são as mais nocivas para a população (Stillman, M. J. et al., 1999; Arseano F. et al., 2006; Szpunar, J. 2005). Esses estudos demonstram, ainda, que peixes de diferentes ecossistemas podem atingir níveis de metilmercúrio (MeHg) com relevância toxicológica, mesmo em áreas consideradas não afetadas por fontes antropogênicas (Arseano F. et al., 2006; Szpunar, J. 2005). As proteínas de baixo peso molecular constituem classe de proteínas que apresentam grande afinidade por metais potencialmente tóxicos, o que permite que essas atuem como inibidoras da ação tóxica dessas espécies metálicas. A literatura destaca que a produção dessas proteínas pelos diferentes organismos está diretamente ligada à absorção dos metais potencialmente tóxicos – destacando-se o cádmio e o mercúrio – ou com a absorção em excesso de metais essenciais – como o zinco e o cobre. No caso, essas proteínas atuam na detoxificação dessas espécies metálicas, como também, no combate aos radicais livres formados devido ao estresse oxidativo provocado pela toxicidade desses metais (Haraguchi, H., 2004). Iniciamos o estudo localizando as proteínas ligadas ao mercúrio.
Material e métodos
Aproximadamente 1g de um pool de tecido muscular das Douradas coletados foi macerado com água deionizada (1:1) e as proteínas obtidas foram separadas por precipitação fracionada com misturas etanol/clorofórmio e etanol/ácido clorídrico, o precipitado foi lavado com etanol gelado e feita a determinação de proteína total através do método de Biureto. Após esses procedimentos, os pellets proteicos foram ressolubilizados em tampão específico e submetidos ao processo de separação por eletroforese bidimensional em gel de poliacrilamida com concentração de 15% (2D–PAGE). Os spots de massa molar inferior a 30 kDa foram recortados e mineralizados por processo de digestão ácida (sulfúrico/peróxido de hidrogênio 4:1) e o Hg quantificado através de técnica de espectrometria de absorção atômica em forno de grafite (GFAAS) (MORAES, P. M. et al., 2013).
Resultado e discussão
A Figura 1 exemplifica um gel obtido nas seis repetições das corridas eletroforéticas das amostras de tecido muscular. Os spots proteicos destacados com círculo são aqueles nos quais foi detectada a presença de mercúrio e determinada as concentrações deste elemento por GFAAS(MORAES, P. M. et al., 2013). Foi feita a conversão da estimativa das massas de spots proteicos e das massas de mercúrio para quantidade de moléculas de spot proteico e quantidade de átomos de mercúrio. Para isso, consideraram-se as respectivas massas molares dos spots proteicos, a massa molar do mercúrio (200,59 g mol-1), a constante de Avogadro (6,022x10²³) e que 1 kDa = 1,661x10-24 g. Esses cálculos possibilitaram a estimativa de quantos átomos de mercúrio estariam presentes por moléculas de spot proteico. Os resultados obtidos nesses cálculos são mostrados na Tabela 1 em termos de número de átomos mercúrio por molécula do spot proteico considerado. Com esses dados é possível estimar a proporção de átomos de mercúrio por molécula de spot proteico, dividindo-se um valor pelo outro. Dessa forma, é possível fazer as seguintes inferições: os spots D3- D5 apresentam aproximadamente um átomo de mercúrio por molécula de spot proteico; o spot D2 apresenta aproximadamente dois átomos de mercúrio por molécula de spot proteico; o spot D1 apresenta três átomos de mercúrio por molécula de spot proteico. Esses resultados sugerem que pode existir uma relação estequiométrica entre o número de átomos de mercúrio e o número de moléculas dos spots proteicos, o que seria uma possível indicação de que esses spots podem se tratar de metaloproteínas(Lima, P. M. et. al., 2010; Santos, F. A. et. al., 2011; Neves, R. C. F. et. al., 2012).
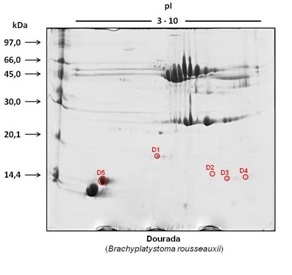
Gel a 15% (m/v) obtido por 2D-PAGE (faixa de pH 3-10) para amostras de tecido muscular de Dourada
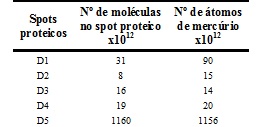
Estimativa do número de átomos de mercúrio por molécula de spot proteico das amostras de tecido muscular de Dourada.
Conclusões
Para o estudo inicial da metalômica esses resultados são de grande importância, pois poderemos concluir, com outras metodologias que serão usadas posteriormente, que se tratam de metaloproteínas e possíveis biomarcadoras de toxicidade de mercúrio.
Agradecimentos
FAPESP 2014/02638-5 2010/51332-5, ANEEL/ESBR PD-6631-0001/2012 e CNPq 472388/2011-8.
Referências
ARNESANO F.; BANCI, L.; BERTINI, I.; CAPOZZI, F.; CIOFI-BAFFONI, S.; CIURLI, S.; LUCHINAT, C.; MANGANI, S.; ROSATO, A.; TURANO, P.; VIEZZOLI, M. S. An Italian contribution to structural genomics: Understanding metalloproteins. Coordination Chemistry Reviews, 250: 1419-1450, 2006.
HARAGUCHI, H. Metallomics as integrated biometal science. J. Anal. At. Spectron., 19: 5-14, 2004.
LIMA, P. M., NEVES, R. C. F., SANTOS, F. A., PEREZ, C. A., DA SILVA, M. A. O., ARRUDA, M. A. Z., CASTRO, G. R., PADILHA P. M. Analytical approach to the metallomic of Nile tilapia (Oreochromis niloticus) liver tissue by SR XRF and FAAS after 2D PAGE separation: Preliminary results. Talanta, 82: 052-1056, 2010.
MORAES, P. M.; SANTOS, F. A.; CAVECCI, B.; PADILHA, C. C. F.; VIEIRA, J. C. S.; ROLDAN, P. S.; PADILHA, P. M. GFAAS determination of mercury in muscle samples of fish from Amazon, Brazil. Food Chemistry, 141: 2614-2617, 2013.
NEVES, R. C. F.; LIMA, P. M.; BALDASSINI, W. A.; SANTOS, F. A.; MORAES, P. M.;CASTRO, G. R.; PADILHA P. M. Fracionamento de cobre em proteínas do plasma, músculo e fígado de tilápia do Nilo. Química Nova, 35: 493-498, 2012.
SANTOS, F. A., LIMA, P. M., NEVES, R. C. F., MORAES, P. M., PEREZ, C. A, DA SILVA, M. A. O., ARRUDA, M. A. Z., CASTRO, G. R., PADILHA, P. M. Metallomic study of plasma samples from Nile tilapia using SR-XRF and GFAAS after separation by 2D PAGE: initial results. Microchimica Acta, 173: 43-49, 2011.
STILLMAN, M. J.; SHAW, C. F.; SUZUKI, K. T. Metallothioneins. In: Metallothioneins. New York: VCH Publishers, 1999. p.1-13.
SZPUNAR, J. Advances in analytical methodologhy for bioinorganic speciation analysis: metallomics, metalloproteomics and heteroatom-tagged proteomics and metabolomics. Analyst, 130: 442-465, 2005.
VALLEE, B. L. Metallothionein historical review and perspectives. In: J.H.R. Kagi, M. Nordberg (Eds.). Metallothionein. Birkhauser, Switzerland, 1999. p.19-40.










