ISBN 978-85-85905-10-1
Área
Bioquímica e Biotecnologia
Autores
Oliveira, W. (UPE) ; Lucas, I. (UFPE) ; Alves, L. (UFPE/UFAM) ; Laís de Sousa, W. (UFPE)
Resumo
Na rizosfera, observa-se uma intensa atividade microbiana, em razão da presença de exsudatos e secreções radiculares que representam as maiores fontes de carbono prontamente disponíveis para os micro-organismos. O objetivo deste trabalho foi isolar micro-organismos da rizosfera da Catingueira e quantificar a atividade enzimática dos isolados produtores de enzimas, CMCase e L-asparaginase, produzidas em meio líquido de fermentação. As condições tempo de fermentação foram determinadas em função da resposta da atividade enzimática de fermentação (24, 48, 72, 96 e 120 horas). As mesmas foram realizadas sobre agitação de 120 rpm a 37ºC. Os resultados demonstram que a maior produção para a CMCase pela bactéria M5 foi de 0,1228 U/mg de proteina em 48 horas de fermentação, enquanto que para a L-as
Palavras chaves
Bactérias; Catingueira; Fermentação
Introdução
Com o desenvolvimento de processos biotecnológicos indo de encontros com as normas de políticas ambientais, necessitando assim de substituição dos processos químicos convencionais por processos enzimáticos a fim de aprimorar a tecnologia atual. As enzimas podem ser encontradas no solo na forma livre, excretadas por células vivas (exoenzimas), liberadas por células que se rompem (endoenzimas) e enzimas ligadas a constituintes celulares (SILVA et al., 2012). Dentre as enzimas, a Celulases e a L-asparaginases, tem apresentado significativa importância biotecnológica. As Celulases são biocatalisadores altamente específicos que atuam em sinergia para a liberação de açúcares, podem ser classificadas, de acordo com seu local de atuação no substrato celulósico, as divide em três grandes gru¬pos: endoglucanases (EnG), que clivam ligações internas da fibra celulósica; exoglucanases (ExG), que atuam na região externa da celulose; e - glicosidases (BG), que hidrolisam oligossacarídeos solúveis em glicose (CASTRO; PEREIRA JR, 2010). A L-asparaginase (L-asparagina aminohidrolase), é a enzima que converte a L-asparagina em ácido L-aspártico e amônia, a qual tem sido usada como um agente quimioterapêutico. O manejo clínico desta enzima é atribuído à redução de L- asparagina, impossibilitando as células tumorais de sintetizar este aminoácido e consequentemente morte destas células. (AMENA, 2010). Com base na especificidade do substrato, L-amidohidrolases bacterianas podem ser divididas em duas grandes classes. A primeira classe, representada pelas asparaginases que utilizam primariamente L-asparagina como substrato. E a segunda classe, também chamada de gutaminase-asparaginases, catalisam a hidrólise de L-asparagina e L- glutamina. (AGHAIYPOUR et al., 2001). Verificando-se crescente
Material e métodos
Amostra da rizosfera da Catingueira no período de inverno serviu de base para o isolamento bacteriano. A amostra foi preparada e diluída em soluções salinas de NaCl a 0,9% (p/v) esterilizadas, nas concentrações 10-3, 10-4 e 10-5, inoculadas em triplicata nos meios específicos para crescimento bacteriológico (Tryptic Soy Agar e Ágar Nutritivo), purificadas e preservadas em óleo mineral (KING et al., 1954). Para avaliar a capacidade das referidas bactérias em degradar a celulose, estas foram inoculadas em meio sólido contendo sais e Carboximetilcelulose (1%) como fonte de carbono, posteriormente foram incubadas a 370C por 24 e/ou 48 horas, e avaliadas quanto à capacidade de degradar a celulose após a revelação com a solução de vermelho congo 5% (QUEIROZ et al., 2002). A Triagem das bactérias produtoras de L-asparaginase foi desenvolvida utilizando o meio M- 9 modificado contendo L-asparagina a 1% e vermelho de fenol como indicador (GULATI et al., 1997). Após selecionar as melhores bactérias produtora do complexo celulolítico e produtoras de L-asparaginase, foram realizadas cinéticas enzimáticas para avaliar o melhor tempo de produção dos complexos enzimáticos, utilizando carboximetilcelulose como substrato indutor para Celulases e L-asparagina como substrato indutor L- Asparaginase, em fermentações submersas nos seus respectivos meios de seleção. Na pré-fermentação foi inoculada alçadas da colônia cultivada (ERNANDES et al., 2003), em meio de crescimento caldo Muller Hington e incubadas sob agitação de 120 rpm por 24h. As fermentações realizadas em triplicada utilizando frascos de Erlenmeyer de 250 mL, com 50 mL dos meios CMC 2% e M-9, e inoculados com o pré-inóculo em uma proporção de 10% (v/v) (MEIRA, 2007). Em seguida os foram frascos incubados sob agitação de 120 rpm
Resultado e discussão
Dentre as 47 amostras bactérias isolados a rizosfera da catingueira no
período
de inverno, 28% das amostras apresentaram atividades celuloliticas, se
destacando as bactérias: BA-1 com índice enzimático 4,5; M-5 com índice
enzimático 2,54 e T-2 com índice enzimático 2,65, sendo estes micro-
organismos
selecionados para realização da cinética de em cultivos submersos sob
agitação,
sendo detectadas apenas atividades celuloliticas significativas na
fermentação
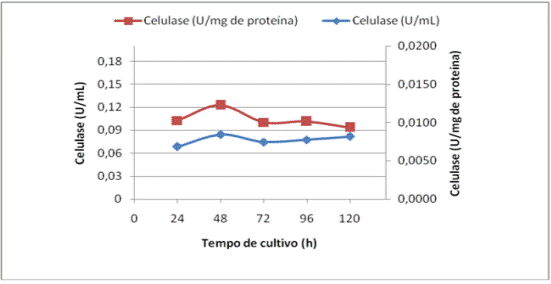
com o isolado bacteriano designado M5. Na Figura 1 estão apresentados os
valores
de atividade CMCase em U/mL e U/mg de proteína em função do tempo de
cultivo,
apresentando um pico de produção com 48 horas de cultivos (0,0084 U/mL e
0,1228
U/mg de proteína).No screening para os ensaios de L-asparaginase, 13 foram
positivas para a produção de L-asparaginase quando comparadas a Escherichia
coli, utilizada no referido trabalho como controle positivo. Das quais duas
linhagens (I4 e I5) se destacaram, apresentando uma produção enzimática num
período de 24 horas, superior ao controle positivo. Para avaliar o melhor
tempo
de cultivo para a excreção da enzima L-asparaginase, as referidas linhagens
foram submetidas a fermentações liquidas sob agitação, estes dados estão
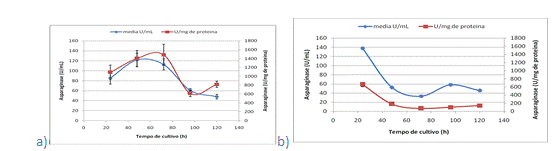
presentes nas Figuras 2. No presente trabalho observa-se que a linhagem I4
apresentou um pico de produção com 48 horas de cultivo correspondente a
121,79
U/mL e 1487,93 U/mg de proteína com 72 horas de cultivo. Entretanto a
linhagem
I5 excretou 137,79 U/mL e 3476,091 U/mg de proteína com apenas 24 horas de
cultivo. Portanto, os resultados obtidos no presente estudo indicam uma alta
incidência de atividade asparaginásica, sugerindo que a maioria das
linhagens
produzem L–asparaginase tipo I, com alta afinidade pelo substrato L-
asparagina.
: Cinetica de produção de CMCase de M5
Cinetica de produção a) de L-asparaginase de I4 b) L-asparaginase de I5
Conclusões
Com os dados obtidos no presente estudo, evidenciou um potencial biotecnológico e farmacológico dos micro-organismos isolados, bem como a importância sobre o estudo da microbiota dos diferentes ecossistemas. Evidenciando a necessidade da realização de experimentos quanto à produção e caracterização das referidas enzimas excretadas por bactérias isoladas da rizosfera da Catingueira no período de inverno.
Agradecimentos
Referências
AGHAIYPOUR, K.; WLODAWER, A.; LUBKOWSKI, J. Structural basis for the activity and substrate specificity of Erwinia chrysanthemi Lasparaginase. Biochemistry.15;40 (19):5655-64. 2001.
AMENA, S.; VISHALAKSHI, N.; PRABHAKAR, M.; DAYANAND, A.; LINGAPPA, K. Production, Purification and Characterization of LAsparaginase from Streptomyces gulbargensis. Brazilian Journal of Microbiology. 41: 173-178. 2010.
BRADFORD, M.Analytical Biochemistry. 72, 284-254, 1976.
CASTRO, A. M.; PEREIRA JR., N. Produção, Propriedades e aplicação de Celulases na hidrólise de resíduos agroindustriais. Química. Nova. v. 33, n. 1, p.181-188, 2010.
ERNANDES, S.; OSHIRO, A.; YAMAOKA, K. ; DEL BIANCHI, V. L. Estudo comparativo do crescimento celular e esporulação de Bacillus thuringiensis var. israelensis em fontes comerciais e alternativas utilizadas em fermentação submersa. Universidade Estadual Paulista (UNESP) – Depto. de Engenharia e Tecnologia de Alimentos- SP - XIV Sinaferm-Simpósio. 2003.
GULATI, R.; SAXENA, R. K.; GUPTA, R. A rapid plate assay for screening L- asparaginase producing microorganisms. Letters in Applied Microbiology. 24, 23–26. 1997.
KING et al., 1954 KING, E. O.; WARD, M. K.; RANEY, D. E. Two simple media for the demonstration of pyocyanin and fluorescin. Journal of Laboratory and Clinical Medicine. v.44, p.301-307, 1954.
MILLER, G. L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem. 31 (3): 426–428. 1959.
MEIRA, J. A. Produção de biosurfactantes por fermentação no estado sólido e desenvolvimento de aplicações para tratamento de solos contaminados por hidrocarbonetos. Dissertação de Mestre em Química. Departamento de Química. Universidade Federal do Paraná. CURITIBA, 2007.
QUEIROZ, G. O. et. al. Seleção de Micro-organismos produtores de celulases e de lacases a partir de efluentes de fabrica de papel. Revista química e Tecnologia. Departamento de química / UNICAP. Ano 1 – nº 1 – jul, dez. 2002.
SANTOS, T. C.; AMORIM, G. M.; BONOMO, R. C. F.; FRANCO, M. Determinação da Atividade de CMCase e FPase da Estipe Fúngica Rhizopus sp. Através da Bioconversão do Resíduo de Seriguela (Spondias Purpurea L.). UNOPAR. Cient. Ciênc. Biol. Saúde 13(3):145-9. Bahia, Brasil, 2011.
SILVA, A. N.; SILVA, A. P.; BATISTA, S. B.; HARDOIM, E. L. Análise quali-quantitativa de bactérias com atividades enzimáticas celulolíticas e proteolíticas isoladas de solo adicionado de vinhaça. Revista de Biologia e Ciências da Terra. Volume 12 - Número 1 - 1º Semestre. 2012.
TIZZOT et al. Asparaginase [EC 3.5.1.1] Asparaginase [EC 3.5.1.1] de Herbaspirillum seropedicae HsZ78. Tuiuti: Ciência e Cultura, pp. 53-72, Curitiba, 2005.










