ISBN 978-85-85905-10-1
Área
Iniciação Científica
Autores
Pereira, M.F. (UFPE) ; Júnior, C.L. (UFPE) ; Fioramonte, M. (UFPE) ; Peixoto, A. (UFPE) ; Júnior, I.A.S. (UFPE) ; Júnior, G.P.C. (UFPE) ; Soares, A.I. (UFPE) ; Lima, N.B. (UFPE)
Resumo
Propomos neste trabalho o mecanismo termodinâmico da síntese de complexos homolépticos Eu(β-dicetonato)3(L)2 a partir do correspondente complexo Eu(β- dicetonato)3(H2O)2. Iniciamos nossos estudos com o exemplo de caso, a síntese do complexo Eu(DBM)3(TPPO)2. Os cálculos foram realizados com o modelo SPARKLE/RM1 utilizando o programa MOPAC 2007. Nossos resultados mostram que o provável mecanismo termodinâmico da reação ocorre por etapas associativas e dissociativas dos ligantes não iônicos envolvidos, sendo as etapas associativas energeticamente favoráveis.
Palavras chaves
Complexos de európio; propriedades termodinâmic; semi-empírico
Introdução
Ligantes β-dicetonatos são comumente utilizados em compostos de coordenação de lantanídeo(III) uma vez que podem atuar como antenas eficientes durante o processo de luminescência quando estes complexos são expostos a radiação ultravioleta (LIMA et al, 2013). Existem algumas formas de aumentar a luminescência de um complexo de lantanídeo(III) como por exemplo: O aumento na diversidade estrutural de complexos de európio(III) torna as transições eletrônicas f-f mais permitidas, logo os valores de rendimento quântico e eficiência quântica são maiores quando comparados com os valores correspondentes em complexos com uma menor diversidade estrutural (LIMA et al, 2013). Para comprovação desta estratégia, foram sintetizados complexos do tipo homolépticos, Eu(β-dicetonato)3(L)2, e complexos do tipo heterolépticcos, Eu(β- dicetonato)3(L1,L2), sendo os ligantes β-dicetonatos= TTA e BTFA e os ligantes não iônicos, L, = TPPO, PTSO e DBSO2. Neste trabalho temos como objetivo principal propor o mecanismo termodinâmico da síntese de complexos homolépticos Eu(β-dicetonato)3(L)2 a partir do correspondente complexo Eu(β-dicetonato)3(H2O)2, começando com o caso do complexo Eu(DBM)3(TPPO)2.
Material e métodos
Inicialmente fizemos os cálculos para a otimização completa de geometria dos compostos de coordenação de európio(III) estudados neste trabalho. Posteriormente, analisamos os valores de entalpia de formação destes. Os cálculos foram realizados com o modelo SPARKLE/RM1 (FILHO et al, 2013 e FILHO et al 2014) utilizando o programa de Química quântica computacional MOPAC 2007.
Resultado e discussão
A síntese do complexo Eu(DBM)3(TPPO)2 consiste na reação de substituição de dois
ligantes água do complexo Eu(DBM)3(H2O)2 por dois ligantes TPPO, Eu(DBM)3(H2O)2
+ 2TPPO → Eu(DBM)3(TPPO)2 + 2H2O, onde o valor da entalpia de reação teórica
calculada pelo modelo SPARKLE RM1 é –43 kcal/mol. Agora passamos a investigar o
provável mecanismo desta reação de substituição, a figura 1 apresenta o provável
mecanismo termodinâmico teórico desta reação.
A partir do mecanismo proposto neste trabalho observamos que a primeira etapa da
reação consiste na coordenação de um ligante TPPO no complexo Eu(DBM)3(H2O)3, o
qual preferencialmente se coordena na posição trans aos ligantes H2O, nesta
etapa . Em seguida, um dos ligantes H2O é eliminado, sendo esta etapa
energeticamente desfavorável, posteriormente mais um ligante TPPO se coordena ao
metal, e por fim o segundo ligante H2O é eliminado formando assim o complexo
Eu(DBM)3(TPPO)2, o qual pode ter os ligantes TPPO nas posições cis e trans um em
relação ao outro.
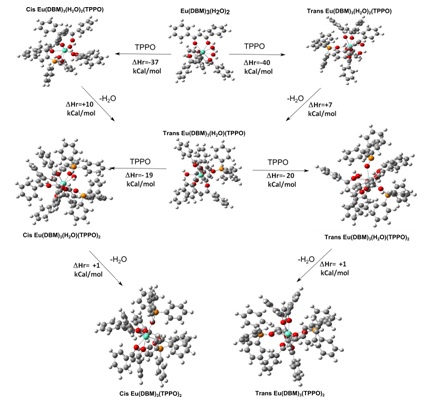
Mecanismo termodinâmico teórico da síntese do complexo Eu(DBM)3(TPPO)2.
Conclusões
Neste trabalho mostramos que o mecanismo termodinâmico da síntese do complexo Eu(DBM)3(TPPO)2 a partir do complexo Eu(DBM)3(H2O)2 ocorre inicialmente pela coordenação de um ligante TPPO, em seguida pela eliminação de um ligante H2O. Posteriormente, ocorre a coordenação do segundo ligante TPPO e por fim a eliminação do segundo ligante H2O. As duas etapas associativas (coordenação do TPPO) são energeticamente favoráveis e as etapas dissociativas (eliminações dos ligantes H2O) não são energeticamente favoráveis.
Agradecimentos
Os autores agradecem ao PET/CAPES, à PROAES/UFPE ao CNPq e ao PRONEX/FACEPE.
Referências
LIMA, N. B. D., Jr, S. A., GONÇALVES, S. M. C., SIMAS, A. M., A Comprehensive Strategy to Boost the Quantum Yield of Luminescence of Europium Complexes, Sci Rep. –UK, v.3, p. 1350044, 2013.
FILHO, M. A. M.; DUTRA, J. D. L.; ROCHA, G. B.; FREIRE, R. O.; SIMAS, A. M. Sparkle/RM1 Parameters for the Semiempirical Quantum Chemical Calculation of Lanthanide Complexes, RSC Adv. 3, 16747, 2013.
FILHO, M. A M.; DUTRA, J. D. L.; ROCHA, G. B.; SIMAS, A. M.; FREIRE, R. O. Semiempirical Quantum Chemistry Model for the Lanthanides: RM1 (Recife Model 1) Parameters for Dysprosium, Holmium and Erbium, PLoS One 9, e86376, 2014.










