ISBN 978-85-85905-10-1
Área
Iniciação Científica
Autores
Xavier, T.M.C. (UFPE) ; Santos, V.F.C. (UFPE) ; Machado, C.M.B. (UFPE) ; Soares, A.I. (UFPE) ; Júnior, G.P.C. (UFPE) ; Brandão, Y.B. (UFPE) ; Silva, A.G. (UFPE) ; Lima, N.B. (UFPE) ; Tres, L. (UPF)
Resumo
Neste trabalho realizamos o estudo teórico e computacional das propriedades vibracionais de infravermelho dos complexos entre compostos nitrogrenados cíclicos (1,10 fenantrolina e 2,2’ bipiridina, figura 1) e ácidos carboxílixos (RCOOH, R=- H, -CH3 e –C6H5). Nossos resultados mostram que tanto para o estiramento O-H quanto para o estiramento C=O as frequências harmônicas de infravermelho foram deslocadas para menores valores no espectro de vibracional de infravermelho. Apenas as intensidades de infravermelho associadas ao estiramento O-H foram bastante aumentadas após a complexação.
Palavras chaves
espectroscopia de infrave; ligações de hidrogênio; ácidos carboxílicos
Introdução
É bem conhecido que as ligações de hidrogênio são estudadas em diversas áreas como, por exemplo, na química, na física e na biologia. Por exemplo, tem-se que as interações intermolecular e intramolecular são as causadoras da estrutura tridimensional, que por sua vez, é responsável pelas atividades biológicas específicas das moléculas da vida, como o DNA e RNA. Uma definição que é bem aceita sobre este tipo de interação é a ligação entre um grupo doador de próton (H-X), e um grupo aceitador de próton (A), formando o complexo X-H˖˖˖A (LIMA et al, 2012). O processo de formação da ligação de hidrogênio pode ocasionar mudanças importantes nas propriedades moleculares e espectroscópicas, como por exemplo, propriedades energéticas, eletrônicas, estruturais e vibracionais das moléculas envolvidas na interação (LIMA et al, 2012). Neste trabalho, temos como objetivo o estudo teórico e computacional das propriedades vibracionais de infravermelho dos complexos entre compostos nitrogrenados cíclicos (1,10 fenantrolina e 2,2’ bipiridina, figura 1) e ácidos carboxílixos (RCOOH, R=-H, -CH3 e –C6H5).
Material e métodos
Realizamos, cálculos de orbitais moleculares usando a teoria do funcional de densidade (DFT) (BECKE, 1993) com o funcional B3LYP (GEERLINGS et al, 2003) com o conjunto de funções base 6-31++G(d,p) para otimização completa de geometria e cálculo dos modos vibracionais dos complexos. Todos os cálculos foram realizados utilizando o programa de química quântica computacional GAUSSIAN 2009 (FRISCH et al, 2009).
Resultado e discussão
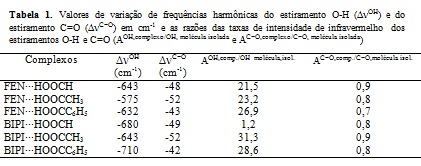
A tabela 1 apresenta as principais mudanças nas propriedades vibracionais dos
estiramentos presentes na estrutura dos complexos. Os estiramentos mais afetados
foram: O-H e C=O, ambos pertencentes aos ácidos carboxílicos. Nossos resultados
mostram que tanto para o estiramento O-H quanto para o estiramento C=O as
frequências harmônicas de infravermelho associadas a estes modos vibracionais
foram deslocadas para menores valores no espectro de vibracional de
infravermelho. Entretanto, o efeito foi mais pronunciado para o estiramento O-H
do que para o estiramento C=O. Por exemplo, para os complexos FEN∙∙∙HOOCH os
valores dos deslocamentos ΔνOH e ΔνC=O foram de -643 e -48 cm-1
respectivamente. Isto acontece porque o estiramento O-H está diretamente
envolvido na ligação de hidrogênio.
As intensidades associadas às frequências harmônicas de infravermelho do
estiramento O-H também foram muito afetadas devido à formação da ligação de
hidrogênio, por exemplo, para o complexo BIPI∙∙∙HOOCCH3 a complexação resultou
num aumento de 52 vezes no valor da intensidade de infravermelho associada a
este modo vibracional. Entretanto, para o estiramento C=O, praticamente não
houve mudanças no valor da intensidade de infravermelho associada a este modo
vibracional, uma vez que este não participa diretamente da ligação de
hidrogênio.
Estrutura da 1,10 fenantrolina e da 2,2 bipiridina.
Conclusões
Nossos resultados mostram que tanto para o estiramento O-H quanto para o estiramento C=O as frequências harmônicas de infravermelho foram deslocadas para menores valores no espectro de vibracional de infravermelho. Entretanto, o efeito foi mais pronunciado para o estiramento O-H do que para o estiramento C=O. Apenas as intensidades de infravermelho associadas ao estiramento O-H foram bastante aumentadas após a complexação.
Agradecimentos
Os autores agradecem ao CNPq,à FACEPE, à PROAES/UFPE e ao PRONEX/FACEPE
Referências
BELARMINO, M. K. D. ; LIMA, N. B. ; RAMOS, M. N. . Hydrogen bonds between acetylene and formic acid: an ab initio study. International Journal of Quantum Chemistry, v. 112, p. 3246-3251, 2012.
A.D. BECKE, Density‐functional thermochemistry. III. The role of exact Exchange. The Journal of Chemical Physics, Vol. 98, P. 5648, 1993.
P. GEERLINGS, F. DE PROFT, W. LANGENAEKER, Conceptual Density Functional Theory. Chemical Reviews. Vol. 103, P. 1793–1874, 2003.
M. J. FRISCH, G. W. TRUCKS, H. B. SCHLEGEL, G. E. SCUSERIA, M. A. ROBB, J. R. CHEESEMAN, G. SCALMANI, V. BARONE, B. MENNUCCI, G. A. PETERSSON, H. NAKATSUJI, M. CARICATO, X. LI, H. P. HRATCHIAN, A. F. IZMAYLOV, J. BLOINO, G. ZHENG, J. L. SONNENBERG, M. HADA, M. EHARA, K. TOYOTA, R. FUKUDA, J. HASEGAWA, M. ISHIDA, T. NAKAJIMA, Y. HONDA, O. KITAO, H. NAKAI, T. VREVEN, J. A. MONTGOMERY, JR., J. E. PERALTA, F. OGLIARO, M. BEARPARK, J. J. HEYD, E. BROTHERS, K. N. KUDIN, V. N. STAROVEROV, R. KOBAYASHI, J. NORMAND, K. RAGHAVACHARI, A. RENDELL, J. C. BURANT, S. S. IYENGAR, J. TOMASI, M. COSSI, N. REGA, J. M. MILLAM, M. KLENE, J. E. KNOX, J. B. CROSS, V. BAKKEN, C. ADAMO, J. JARAMILLO, R. GOMPERTS, R. E. STRATMANN, O. YAZYEV, A. J. AUSTIN, R. CAMMI, C. POMELLI, J. W. OCHTERSKI, R. L. MARTIN, K. MOROKUMA, V. G. ZAKRZEWSKI, G. A. VOTH, P. SALVADOR, J. J. DANNENBERG, S. DAPPRICH, A. D. DANIELS, Ö. FARKAS, J. B. FORESMAN, J. V. ORTIZ, J. CIOSLOWSKI, and D. J. FOX, Gaussian 09, Revision D.01, Gaussian, Inc., Wallingford Ct, 2009.










