ISBN 978-85-85905-10-1
Área
Iniciação Científica
Autores
Silva, H.H.S. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Vieira, T.P. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Silva, J.V.D. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Cabral, M. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Lima, N.B. (UNIVERSIDADE FEDERAL DE PERNAMBUCO)
Resumo
Realizamos neste trabalho o provável mecanismo termodinâmico da tautomerização da ftalimida a partir da complexação com ácidos carboxílicos via ligação de hidrogênio. Utilizamos os níveis de cálculo DFT B3LYP/6-31++G(d,p) e o programa de química quântica computacional Gaussian 2009. Nossos resultados mostraram que em todos os casos, a formação da ligação de hidrogênio nos complexos entre a ftalimida e ácido carboxílico desloca o equilíbrio químico para o complexo entre o tautômero da ftalimida e o ácido carboxílico. O processo de tautomerização da ftalimida ocorre pela transferência de próton durante a reorganização eletrônica durante o processo de formação da ligação de hidrogênio.
Palavras chaves
ftalimida; entalpia de reação; ligação de hidrogênio
Introdução
É bem conhecido que cálculos ab initio de orbitais moleculares e cálculos DFT podem ser utilizados para a previsão teórica e computacional de propriedades moleculares de sistemas químicos (LIMA et a, 2012). Podemos citar como exemplos: geometria otimizada, ou seja, a geometria mais provável de existir; energias de estabilização; entalpias de formação; espectros de infravermelho; espectros RAMAN e deslocamentos químicos dos núcleos presentes das estruturas. Imidas cíclicas são importantes compostos orgânicos que dependendo dos grupos substituintes presentes nas estruturas podem ter potenciais aplicações em biologia e medicina, como por exemplo, podem diminuir taxas de colesterol e triglicerídeos do sangue. As imidas cíclicas possuem sítios que podem interagir com moléculas doadoras de próton para formar complexos de ligação de hidrogênio (LIMA et al, 2011). Neste trabalho temos como objetivo verificar o provável mecanismo termodinâmico da tautomerização do complexo envolvendo a ftalimida e o ácido fórmico a partir de estudos teóricos e computacionais das propriedades termodinâmicas das etapas destes processos.
Material e métodos
Foram empregados cálculos usando a teoria do funcional de densidade (DFT) (BECKE, 1993) com o funcional B3LYP (GEERLINGS et al, 2003) com o conjunto de funções base 6-31++G(d,p) para otimização completa de geometria, para obtenção dos valores de entalpia de formação e para a simulação dos modos vibracionais dos complexos e das moléculas livres de complexação. Todos os cálculos foram realizados utilizando o programa de química quântica computacional GAUSSIAN 2009 (FRISCH et al, 2009).
Resultado e discussão
A figura 1 apresenta o equilíbrio químico entre a ftalimida (FTA) e sua espécie
tautômerica (TAU) e o equilíbrio formado pelos respectivos complexos de ligação
de hidrogênio com o ácido fórmico (FTA---HOOCH e TAU---HOOCH). Verificamos que a
ftalimida livre de complexação é a espécie predominante entre as duas formas
possíveis. Entretanto, ao interagir com o ácido fórmico, a espécie predominante
passa a ser a tautomérica. Em seguida, passamos a investigar o provável
mecanismo termodinâmico. A figura 2 apresenta o mecanismo termodinâmico da
formação do complexo entre ftalimida e ácido fórmico (FTA---HOOCH) e da
tautomerização catalizada pela formação da ligação de hidrogênio. Consideramos
que a primeira etapa do mecanismo consistiu no estudo do equilíbrio químico
formado por duas moléculas de ácido fórmico. Os cálculos revelaram que
provavelmente deve haver a formação do dímero ácido. Em seguida, consideramos
que as duas moléculas de ácido fórmico poderiam interagir com uma ou duas
moléculas de ftalimida. No primeiro caso, ocorre a formação de um intermediário
estável o qual ao interagir com mais uma molécula de ftalimida há a formação de
2 complexos FTA---HOOCH. No segundo caso, a possibilidade de interação com duas
moléculas de ftalimida, teríamos imediatamente a formação de 2 complexos FTA---
HOOCH sem a formação de uma estrutura intermediária. Posteriormente, em ambos os
casos, observamos o deslocamento do equilíbrio químico para o complexo de
ligação de hidrogênio envolvendo a forma tautomérica da ftalimida, TAU---HOOCH.
Provavelmente, o processo ds tautomerização da ftalimida ocorreu pela
transferência de próton durante a reorganização eletrônica durante a formação da
ligação de hidrogênio.
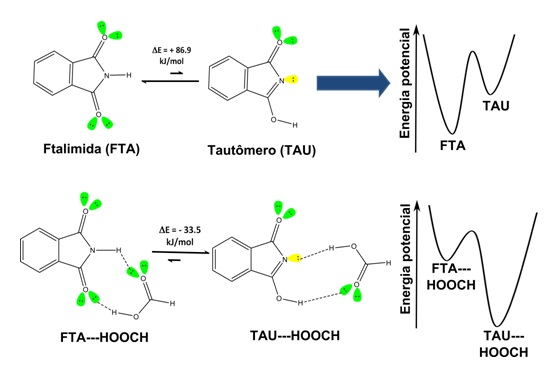
Equilíbrio químico entre as espécies: ftalimida e tautômero; complexo FTA---HOOCH e complexo TAU--- HOOCH.
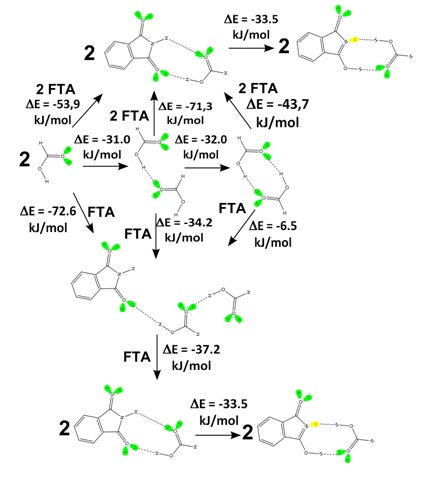
Mecanismo termodinâmico teórico da tautomerização da ftalimida catalisada por hidrogênio ácido.
Conclusões
Verificamos que a ftalimida livre de complexação é a espécie predominante comparando com a correspondente espécie tautomérica. Entretanto, ao interagir com o ácido fórmico, a forma predominante passa a ser a tautomérica. Posteriormente, propomos o mecanismo termodinâmico da tautomerização da ftalimida catalizada pela ligação de hidrogênio, onde nossos cálculos revelaram que provavelmente deve haver inicialmente a formação do dímero ácido e, após adição de uma molécula de ftalimida, há a formação de um intermediário e posteriormente a formação dos complexos de ligação de hidrogênio.
Agradecimentos
Os autores agradecem ao CNPq, à PROAES/UFPE e ao PRONEX/FACEPE.
Referências
LIMA, N. B. D. and RAMOS, M. N., A Theoretical Study Of The Molecular Structures And Vibrational Spectra Of The N2O-(HF)2. Journal Of Molecular Structure, V. 1008, P. 29-34, 2012.
LIMA, N. B. D, RUSU, V. H., M.N. RAMOS, Hydrogen bonds between phthalimide and hydrogen fluoride: A theoretical study, Int. J. Quantum Chem. 111 1387–1394, 2011.
A.D. BECKE, Density‐functional thermochemistry. III. The role of exact Exchange. The Journal of Chemical Physics, Vol. 98, P. 5648, 1993.
P. GEERLINGS, F. DE PROFT, W. LANGENAEKER, Conceptual Density Functional Theory. Chemical Reviews. Vol. 103, P. 1793–1874, 2003.
M. J. FRISCH, G. W. TRUCKS, H. B. SCHLEGEL, G. E. SCUSERIA, M. A. ROBB, J. R. CHEESEMAN, G. SCALMANI, V. BARONE, B. MENNUCCI, G. A. PETERSSON, H. NAKATSUJI, M. CARICATO, X. LI, H. P. HRATCHIAN, A. F. IZMAYLOV, J. BLOINO, G. ZHENG, J. L. SONNENBERG, M. HADA, M. EHARA, K. TOYOTA, R. FUKUDA, J. HASEGAWA, M. ISHIDA, T. NAKAJIMA, Y. HONDA, O. KITAO, H. NAKAI, T. VREVEN, J. A. MONTGOMERY, JR., J. E. PERALTA, F. OGLIARO, M. BEARPARK, J. J. HEYD, E. BROTHERS, K. N. KUDIN, V. N. STAROVEROV, R. KOBAYASHI, J. NORMAND, K. RAGHAVACHARI, A. RENDELL, J. C. BURANT, S. S. IYENGAR, J. TOMASI, M. COSSI, N. REGA, J. M. MILLAM, M. KLENE, J. E. KNOX, J. B. CROSS, V. BAKKEN, C. ADAMO, J. JARAMILLO, R. GOMPERTS, R. E. STRATMANN, O. YAZYEV, A. J. AUSTIN, R. CAMMI, C. POMELLI, J. W. OCHTERSKI, R. L. MARTIN, K. MOROKUMA, V. G. ZAKRZEWSKI, G. A. VOTH, P. SALVADOR, J. J. DANNENBERG, S. DAPPRICH, A. D. DANIELS, Ö. FARKAS, J. B. FORESMAN, J. V. ORTIZ, J. CIOSLOWSKI, and D. J. FOX, Gaussian 09, Revision D.01. Gaussian, Inc., Wallingford CT, 2009.










