ISBN 978-85-85905-10-1
Área
Iniciação Científica
Autores
Peixoto, A. (UFPE) ; Lima, N. (UFPE) ; Simas, A. (UFPE) ; Gonçalves, S. (UFPE)
Resumo
Neste trabalho estudamos o efeito do lítio, nas propriedades luminescentes dos complexos tetrakis de európio(III) do tipo Eu(β-dicetonato)4M, sendo os β- dicetonatos: DBM(dibenzoilmetano), BTFA(benzoiltrifluoroacetona) e TTA(tenoiltrifluoroacetona), e os íons(M): sódio(Na+), potássio(K+) e lítio(Li+). Realizamos de forma sistemática o estudo teórico e computacional das propriedades moleculares destes complexos e a síntese destes complexos por rotas otimizadas. Nossos resultados mostraram que para o caso destes complexos com o ligante simétrico DBM os metais alcalinos interagem com três ligantes β- dicetonatos distorcendo o poliedro de coordenação, o que resultou numa conformação assimétrica, fato que reflete um aumento significativo nos valores de eficiência quântica de emissão.
Palavras chaves
európio(III); lítio; semi-empírico
Introdução
Os complexos de európio(III) têm tido uma vasta aplicação na comunidade científica. Um dos principais motivos é a luminescência apresentada por tais complexos. A luminescência do európio se dá pela conversão da energia absorvida quando submetidos à radiação ultravioleta. O processo de conversão de luz de complexos de íon Eu3+ envolve três etapas: absorção de luz ultravioleta pelos ligantes, transferência de energia dos ligantes para o íon Eu3+ e emissão de luz com comprimento de onda na região do vermelho pelo íon Eu3+, chamado de efeito antena. Para que isso ocorra eficientemente, temos que escolher boas antenas para complexar com o európio. Recentemente, foi relatado que os complexos tetrakis de íon Eu3+ com quatro ligantes β-dicetonatos, podem ser muito luminescentes quando expostos à radiação ultravioleta1. Neste trabalho, temos como objetivo analisar o efeito do contraíon lítio(Li+) nas propriedades luminescentes dos complexos tetrakis de európio(III) do tipo Eu(β-dicetonato)4M.
Material e métodos
Procedimento computacional A parte teórica e computacional do trabalho consistiu na otimização da geometria molecular dos complexos, ou seja, calcular a geometria mais provável de existir. Desta forma, obtemos informações importantes a respeito das entalpias de formação dos complexos bem como valores de propriedades estruturais, por exemplo, comprimentos de ligações. Os cálculos foram realizados com o modelo SPARKLE/AM1(FREIRE et al, 2013) utilizando o programa de Química quântica computacional MOPAC 2012. Procedimento experimental geral Em relação à parte experimental do nosso trabalho, as sínteses para preparação dos complexos tetrakis de európio (III) com os diferentes íons alcalinos M (íon Li+, íon Na+ e íon K+) foram realizadas por rotas de Brito (QUIRINO et al, 2008), as quais foram otimizadas pelo nosso grupo de pesquisa. As sínteses realizadas estão apresentadas na Figura 1.
Resultado e discussão
Após a síntese dos complexos tetrakis de európio(III) e das medidas dos valores
de eficiência quântica(η), observamos que nos complexos tetrakis com ligante DBM
e contraíon lítio apresentavam luminescência visivelmente maior que os complexos
com os contraíons sódio e potássio desse mesmo ligante. Verificamos um aumento
de 1300% no valor da eficiência quântica para Eu(DBM)4Li em relação ao
Eu(DBM)4K. Isto não era esperado, uma vez que para os complexos iguais com os
ligantes TTA e BTFA a situação contrária era observada.
A partir desses resultados, passamos a investigar as razões levaram a este
fenômeno. Para isto, realizamos a otimização da geometria dos complexos tetrakis
de európio(III). Supomos nesta etapa que os metais alcalinos além de interagirem
com os ligantes β-dicetonatos, também poderiam realizar uma ou duas interações
coordenadas com moléculas de água. Após a otimização, observamos que os metais
alcalinos formavam uma ligação com três dos oito oxigênios dos ligantes levando
assim a uma distorção no poliedro de coordenação, fato que foi mais intenso nos
complexos que continham o Li+ uma vez que esse comprimento da ligação é menor,
indicando que a interação deste metal alcalino com os ligantes β-dicetonatos é
mais intensa.
Na tabela 1 apresentamos os valores dos comprimentos de ligação: Eu---O, M---O e
M---OH2 e os valores de entalpia de formação de todos os complexos. Verificamos
que a estabilidade dos complexos varia no sentido K>Na>Li e os complexos que
possuem duas águas, são os mais estáveis. Isso pode ser justificado pela
distorção ser menor nos complexos com o potássio. Pelos comprimentos da ligação,
é possível observar que a maior distorção do poliedro de coordenação é
apresentada, de fato, aos complexos de lítio ainda que com a presença da água.
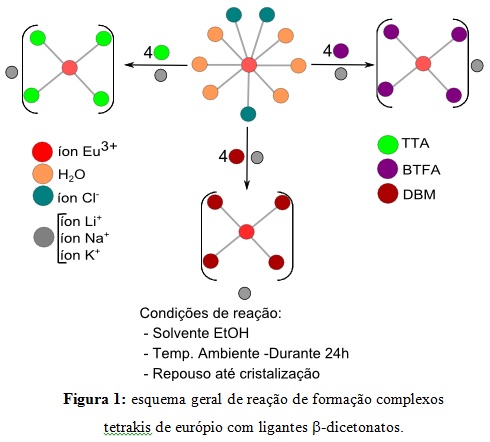
esquema geral de reação de formação de complexos tetrakis de európio(III) com ligantes beta- dicetonatos
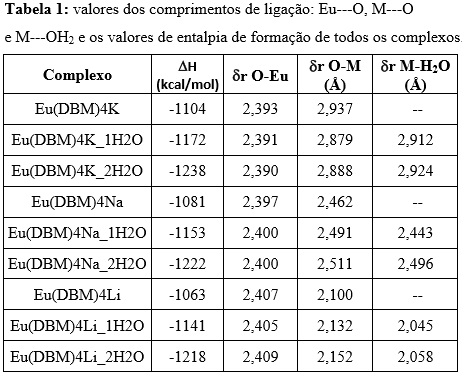
os valores do comprimentos de ligação: Eu---O, M---O e M---OH2 e os valores de entalpia de formação de todos os complexos
Conclusões
Apresentamos neste trabalho que a presença do contraíon lítio na estrutura de complexos tetrakis de európio(III) com o ligante simétrico DBM, provoca uma distorção estrutural maior do que nos complexos com os metais alcalinos sódio e potássio. Este fenômeno reflete em maiores valores de eficiência quântica, onde observamos um aumento de 1300% no valor da eficiência quântica para Eu(DBM)4Li em relação ao Eu(DBM)4K.
Agradecimentos
Os autores agradecem ao CNPq, a PROAES/UFPE, ao inctINAMI, ao PET-Química UFPE e ao PRONEX/FACEPE.
Referências
FREIRE, RICARDO OLIVEIRA ; ROCHA, GERD BRUNO ; SIMAS AM, Sparkle Model for the Calculation of Lanthanide Complexes: AM1 Parameters for Eu(III), Gd(III) and Tb(III).. Inorganic Chemistry, ACS, Estados Unidos, v. 44, n.9, p. 3299-3310, 2005.
QUIRINO, W ; LEGNANI, C ; DOSSANTOS, R ; TEIXEIRA, K ; CREMONA, M ; GUEDES, M ; BRITO, H Thin Solid Films, v. 517, p. 1096-1100, 2008.










