ISBN 978-85-85905-10-1
Área
Iniciação Científica
Autores
Costa, L.H.M. (UNIVERSIDADE FERAL DO RIO GRANDE DO NORTE) ; Lima, F.J.S. (UNIVERSIDADE FERAL DO RIO GRANDE DO NORTE) ; Silva, A.O. (UNIVERSIDADE FERAL DO RIO GRANDE DO NORTE)
Resumo
O acetato de uranilo é conhecido como uma espécie bastante estável. Alguns autores tem se mobilizado na síntese e estudos de compostos derivados com essa espécie, devido a recentes provas de sua funcionalização. Neste trabalho avaliou-se sua estabilidade térmica e associou-se com estudos cristalográficos e de modelagem, com o propósito de avaliar e justificar algumas de suas propriedades de ligação. Realizamos a modelagem molecular para visualizar melhor o ambiente químico em torno do urânio e avaliar dados estereoquímicos do composto. Com os resultados das análises térmicas podemos observar dois eventos. No primeiro, ocorreu entre 84 - 163 °C, que está associado a perda de duas moléculas de água. Já no segundo, nota- se uma perda de 24,503%, na qual é uma perda de massa dos íons acetatos.
Palavras chaves
Análise térmica; estereoquímica; acetato de uranilo
Introdução
O propósito do trabalho é avaliar o estudo térmico do acetato de uranila di- hidratado e correlacionar com sua estrutura molecular. A associação dessas técnicas permite diferenciar os tipos de interação das moléculas de água presentes em sua estrutura, se estão fisicamente ligadas ou quimicamente ligadas, apoiado em referências bibliográficas e modelagem molecular. Análise termogravimétrica (TGA) é uma das técnicas analíticas que mede a perda/ganho de massa da amostra em função da temperatura ou tempo. Já a termogravimetria é um arranjo matemático para demonstrar a variação de massa em relação a variação do tempo. As técnicas térmicas têm grande potencial e vêem sendo utilizadas em diversas aplicações. Alguns materiais estudados como: materiais biológicos, cerâmicas, vidros, compostos inorgânicos, entre outros, têm sido vastamente estudados e caracterizados. De acordo com CLOUGH (CLOUGH, P. S. et. al., 1969), a decomposição térmica do acetato de uranilo tem estudos breves. Percebe-se que o sal dihidratado era estável até 100°C, onde inicialmente elimina água de cristalização. Após esse evento, ocorre a decomposição do acetato, que se encontra também coordenado ao íon uranilo (UO2+2), segundo HOWATSON e GREV (HOWATSON, J. and GREV, D. M., 1975) e LIMA (LIMA, F. J. S. et. al., 2014). Sugere também que ao final da decomposição há um pequeno aumento de massa, e isso se deve ao fato de ser analisado em atmosfera de ar e reagir com a atmosfera, donde o composto sofre oxidação, originando o óxido U3O8. A Modelagem Molecular compreende um número de ferramentas e métodos computacionais e teóricos, que tem como objetivo, entender e prever comportamento de sistemas reais (RODRIGUES, C.R., 2001). Realizamos a modelagem molecular para avaliar dados estereoquímicos do sal.
Material e métodos
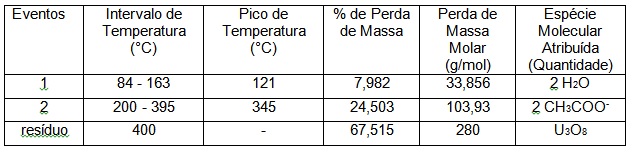
Foi realizada a análise térmica do acetato de uranilo (MERCK), utilizado em nossas pesquisas preliminares. As curvas termogravimétricas foram registradas em uma termo-balança Shimadzu TGA-50H com razão de aquecimento de 10 oC min-1 sob atmosfera dinâmica de ar, permitindo obter a composição e a estabilidade de compostos intermediários e resíduos. O estudo da análise térmica foi dividido em dois eventos: o primeiro relativo à perda de duas moléculas de água e o segundo, a decomposição do acetato, que está coordenado ao íon uranilo. A Tabela 01 ilustra alguns dados relevantes no estudo de análise térmica e Figura 01, mostra a curva de decomposição térmica do composto. Usamos o programa WebLab ViewerPro para realizar os estudo estereoquímico do acetato de uranilo di-hidratado, com base em informações da literatura, tomando como base o trabalho de HOWATSON e GREV (HOWATSON and GREV, 1975), para otimizar a modelagem.
Resultado e discussão
De acordo com os resultados das análises térmicas podemos observar que ocorreram
dois eventos. Nesses eventos observa-se que a porcentagem de perda de massa no
primeiro evento, que ocorreu em uma variação de temperatura entre 84 - 163 °C
(com um pico de temperatura em 121 °C), houve uma perda de 7,982%, que está
relacionado a perda de duas moléculas de água. Segundo a literatura (HOWATSON
and GREV, 1975) a análise da estrutura molecular do cristal, indica que há uma
água ligada covalentemente com o urânio e a outra água de cristalização
realizando interações do tipo ligações de hidrogênio com um dos acetatos, onde
há um acetato que se encontra bidentado ao urânio e o segundo monodentado,
fazendo ponte com a célula vizinha. Já no segundo evento, de acordo com a curva
obtida, nota-se uma perda de 24,503%, na qual é uma perda de massa dos acetatos
que estão coordenados ao o íon uranilo. Nesse evento ocorre simultaneamente a
oxidação do uranilo, onde ele se oxida formando o óxido de urânio U3O8, ficando
como resíduo da decomposição atingindo temperatura de 400 °C. Percebe-se com a
análise térmica que o acetato de uranilo é um composto estável até uma
temperatura de 200 °C. Há também algumas informações que podemos observar da
análise térmica. De acordo com CLOUGH et. al., (CLOUGH et. al., 1969) mostra que
a diferencial térmica do acetato de uranilo em atmosfera de ar possui no
primeiro evento um pico endotérmico na referida variação de temperatura, já no
segundo pico mostra-se uma decomposição exotérmica que ocorre de forma rápida,
ocorrendo o que se chama pirólise dos acetatos.
Dados da análise térmica do acetato de uranilo di- hidratado
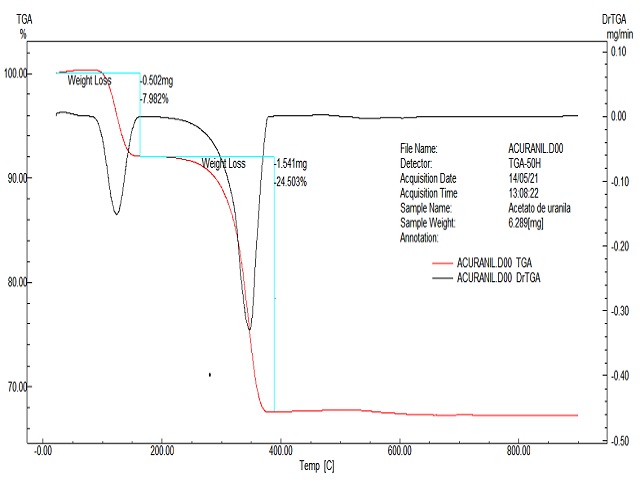
Curva de análise térmica do Acetato de uranila di- hidratado UO2(H3CCOO)2.2H2O
Conclusões
Observou-se que entre 84 – 163 oC, ocorre a perda de duas moléculas de águas no primeiro evento mostrado na Figura 01. Analisando juntamente com a estrutura do mono cristal, percebemos que há água de coordenação, que está ligada mais fortemente (interação mais covalente), e há água de cristalização, esta realizando interações de ligações de hidrogênio em forma de ponte com outra estrutura de célula unitária, que se supõe ser uma interação mais fraca que a água de coordenação. Já no segundo evento há perdas de massa referente aos acetatos.
Agradecimentos
Agradecemos ao PIBIT / PPPg / UFRN / CNPq, pelo apoio financeiro à COSTA, L . H. M., (bolsita PIBIT) e aos incentivos à pesquisa em química.
Referências
1. CLOUGH, P. S.; DOLLIMORE, D. and GRUNDY, P. - The Thermal Decomposition Of Uranyl Acetate, J. inorg. Nucl. Chem., 1969, Vol. 31, 361 to 370
2. HOWATSON, J. and GREV, D. M. - Crystal And Molecular Structure Of Uranyl Acetate Dihydrate*, J. inorg. Nact Chem., 1975, Vol. 37, 1933-1935.
3. LIMA, Francisco José Santos; COSTA, Luiz Henrique Medeiros da; SILVA, Ademir Oliveira da - Estudos Espectroquímicos Do Íon Uo22+ Coordenado No Acetato De Uranila UO2(H3CCOO)2.2H2O, Periódico Tchê Química, 2014 – no prelo.
4. RODRIGUES, C. R. Modelagem Molecular, Química Nova na Escola, Edição Especial, fevereiro de 2001, Vol. 3, pág. 43-49










