ISBN 978-85-85905-10-1
Área
Química Inorgânica
Autores
Torres, M. (UNIVERSIDADE FEDERAL DE VIÇOSA) ; Menezes, D. (UNIVERSIDADE FEDERAL DE VIÇOSA) ; Borges, E. (UNIVERSIDADE FEDERAL DE VIÇOSA) ; Teófilo, R. (UNIVERSIDADE FEDERAL DE VIÇOSA)
Resumo
Diante de um grande potencial biológico como agentes antimicrobianos e antitumorais, compostos pertencentes à classe dos ditiocarbamatos têm abordado como alvo terapêutico enzimas essenciais à sobrevivência de microorganismos patogênicos como a urease, além disso, muitos desses derivados são empregados nas áreas industrial, medicinal e de síntese1. Neste trabalho, foram realizados ensaios de inibição da enzima urease por ligantes em química de coordenação da classe dos ditiocarbamatos (dimetilditiocarbamato de sódio; dietilditiocarbamato de sódio e pirrolidinoditiocarbamato de amônio). Estes ligantes inibem pronunciadamente esta enzima com as reações monitoradas via espectroscopia eletrônica na região do visível.
Palavras chaves
urease; ligantes ditiocarbamatos ; inibição enzimática
Introdução
Urease é uma metaloenzima rica em Ni(II) responsável pela hidrólise da uréia, reação essencial para a sobrevivência de bactérias e fungos patogênicos, além de plantas2. No âmbito da química medicinal, ditiocarbamatos apresentam inúmeras aplicações, as quais destacam-se a atividade antitumoral de complexos ditiocarbamatos à base de ouro, um vasto emprego como catalisadores e aditivos na indústria de plásticos e borracha, pesticidas e um grande potencial biológico como agentes antimicrobianos1. Dietilditiocarbamato de sódio, por exemplo, possui emprego como fármaco auxiliar à cisplatina, diminuindo seu efeito colateral relativo a nefrotoxicidade em pacientes sob tratamento do câncer. Sais dos derivados pirrolidino, dietil e dimetil ditiocarbamatos, avaliados neste trabalho, apresentam pronunciada atividade de inibição frente à enzima anidrase carbônica, correlacionada a patologias diversas3. Dessa forma, o presente trabalho teve como objetivo realizar uma avaliação farmacológica inicial dos ligantes comerciais – dimetilditiocarbamato de sódio (MDTC), dietilditiocarbamato de sódio (EDTC) e pirrolidinoditiocarbamato de amônio (PDTC) – frente à enzima urease.
Material e métodos
Os ensaios foram conduzidos mediante a adição de alíquotas de uma solução de urease (2,5 mmolL-1) à soluções contendo os ligantes ditiocarbamatos (5,041x10-2 mmolL-1), uréia (2,5 mmolL-1) e vermelho de fenol (2,5 mmolL-1) em tampão fosfato-salina (PBS) com pH igual a 7. Urease promove a catálise da uréia com formação de amônia e gás carbônico em meio biológico. Desta forma, a liberação de amônia foi monitorada cineticamente por 50 minutos mediante o emprego do indicador vermelho de fenol a 570 nm. Visto que a concentração de amônia liberada no sistema é proporcional à quantidade de urease, a atividade da enzima foi verificada indiretamente.
Resultado e discussão
A concentração de amônia é significativamente maior para a reação na ausência dos ligantes comparado à presença destes, figura 1. O ligante EDTC apresentou uma atividade mais pronunciada em relação aos derivados MDTC e PDTC reduzindo de maneira expressiva a atividade de degradação de uréia realizada pela enzima.
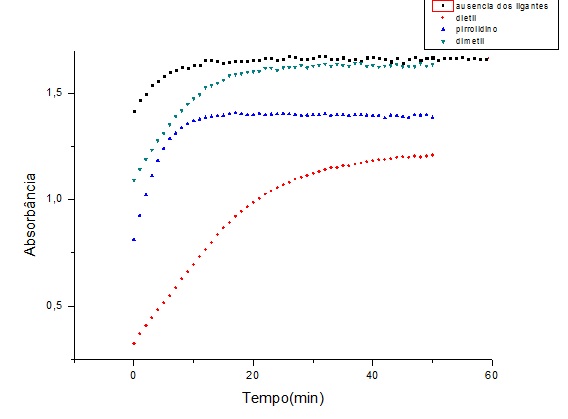
Monitoramento da atividade de urease via liberação de amônia a 570nm na ausência e presença dos ligantes ditiocarbamatos.
Conclusões
Pôde-se constatar que os ligantes ditiocarbamatos participaram de maneira eficaz na diminuição da atividade da enzima, mostrando uma redução expressiva na concentração de amônia durante o tempo reacional a 570 nm, atuando como potenciais inibidores desta.
Agradecimentos
CNPQ, Fapemig, Universidade Federal de Viçosa, Viçosa MG.
Referências
[1] MENEZES, D. C. Síntese e caracterização de complexos de ditiocarbamatos de Sn(IV), Ln(III), Ga(III) e metais de transição: Decomposição térmica e perfil farmacológico in vitro. Universidade Federal de Minas Gerais, Tese de Doutorado, 2008.
[2] KRAJEWSKA, B.; CIURLI, S. Jack bean (Canavalia ensiformis) urease. Probing acid–base groups of the active site by pH variation. Plant Physiology and Biochemistry (43) 651–65, 2005.
[3] CARTA, F; AGGARWAL, M; MARESCA, A. et al. Dithiocarbamates Strongly Inhibit Carbonic Anhydrases and Show Antiglaucoma Action in Vivo. J. Med. Chem. (55) 1721−1730, 2012.










