ISBN 978-85-85905-10-1
Área
Química Inorgânica
Autores
Bottega, F.C. (UFV) ; Oliveira, M.R.L. (UFV) ; Rubinger, M.M.M. (UFV)
Resumo
Cinco novos compostos de fórmula geral: (Ph4P)[SnPh3(RSO2N=CS2)], onde R= C6H5 (1), 4-FC6H4 (2), 4-ClC6H4 (3), 4-BrC6H4 (4), 4-IC6H4 (5), foram obtidos da reação com N-R-sulfonilditiocarbimato de potássio apropriado (RSO2N=CS2K2) e cloreto de trifenilestanho(IV) com cloreto de tetrafenilfosfônio em dimetilformamida. Os novos compostos foram caracterizados por espectroscopias vibracional, 119Sn Mössbauer e de ressonância magnética nuclear de 1H, 13C e 119Sn e condutância eletrolítica. Os espectros de RMN de 1H e 13C apresentaram os sinais esperados para cátion e ânion. A condutividade molar indicou a proporção 1:1 complexos catiônico:aniônico.
Palavras chaves
Ditiocarbimatos; organoestânicos; tri-organoestânicos
Introdução
Compostos organoestânicos, caracterizados pela presença de uma ou mais ligação covalente (Sn-C), são diferenciados pela natureza dos grupos orgânicos ligados ao estanho que podem ser do tipo RSnX3, R2SnX2, R3SnX e R4Sn, em que R é um grupo alquila ou arila e X é uma espécie aniônica, por exemplo, haletos, óxido ou hidróxido ou outro grupo funcional (HOCH 2001). A atividade biológica dos organoestânicos varia com o tipo de grupo R e quantidade, sendo que os compostos organoestânicos de fórmula geral R3SnX têm sido mais ativos (TSANGARIS,et al 1992). Os ditiocarbamatos são uma classe de compostos orgânicos amplamente estudados. Apresentam potencial aplicação biológica como agentes antitumorais (GIELEN, et al 1996), antifúngicos (HEARD, 2005) e antibacterianos. Ditiocarbimatos são estruturalmente semelhantes aos diticarbamatos diferindo apenas no tipo de ligação entre o átomo de carbono e o de nitrogênio em seu grupo funcional. Apesar da semelhança estrutural, os ditiocarbimatos são compostos com estudos ainda muito restritos. O primeiro relato de atividade biológica é bastante recente, de 2009 em que foram descobertas atividades de complexos de zinco com ditiocarbimatos derivados de sulfonamidas atuando como fungicidas (ALVES, et al 2009). Este trabalho consistiu na síntese e caracterização de 5 compostos orgaoestânicos derivados de ditiocarbimatos. Os compostos foram caracterizados por espectroscopias de IV, RMN de 1H, 13C,119Sn e 119Sn Mössbauer e condutividade molar.
Material e métodos
Foram sintetizados cinco novos compostos de fórmula geral (Ph4P) [Sn(Ph)3(RSO2N=CS2)], onde R= C6H5 (1), 4-FC6H4 (2), 4- ClC6H4 (3), 4-BrC6H4 (4), 4- IC6H4 (5). Os ditiocarbimatos de potássio foram sintetizados a partir das sulfonamidas apropriadas em reação com dissulfeto de carbono e hidróxido de potássio, de acordo com a literatura (HUMMEL, 1989) As sínteses de trifenil(N-R-sulfonilditiocarbimato)estanato(IV) de tetrafenilfosfônio foram realizadas partindo-se de 2 mmol do ditiocarbimato de potássio apropriado e 2 mmol de cloreto de trifenilestanho em 15mL de dimetilformamida. A mistura ficou sob agitação por 1 hora e 30 minutos à temperatura ambiente. Em seguida, adicionaram-se 2,00 mmol de cloreto de tetrafenilfosfônio. O precipitado branco obtido foi filtrado, lavado com água destilada e seco a pressão reduzida. Os rendimentos para 1, 2, 3, 4 e 5 foram de 58,5; 80,0; 83,3; 67,0 e 95,5% respectivamente. Para todos os compostos foram determinadas as faixas de fusão (aparelho Microquímica MQAPF-302 Mettler FP% sem correção), condutividade molar (solução de DMF a 25°C com aparelho Jenway 4010 Conductivity Meter) e obtidos espectros no infravermelho (espectrofotômetro Perkin Elmer FT-IR 1000). Os espectros de RMN de 1H (300 MHz) e de 13C (75 MHz) foram obtidos em espectrômetro VARIAN (MERCURY 300) em DMSO-D6 com TMS como padrão interno e os de 119Sn (75 MHz) em aparelho Bruker AVANCE DPX 200. Os dados de espectroscopia Mössbauer foram coletados à temperatura de 78K em um espectrômetro de aceleração constante convencional com uma fonte de CaSnO3 mantido à temperatura ambiente.
Resultado e discussão
Os cinco compostos são sólidos brancos, insolúveis em água, éter etílico,
hexano, etanol. Apresentaram faixas de fusão de no máximo 3ºC, indicando um bom
grau de pureza. Os resultados obtidos para a condutância eletrolítica de 1-5
estão consistentes com a proporção 1:1 tetrafenilfosfônio:complexo aniônico de
estanho (GEARY, 1971). Observou-se nos espectros vibracionais que bandas
relativas ao estiramento assimétrico de CS2 e C=N estão deslocadas
para menores e maiores números de onda respectivamente em relação as do
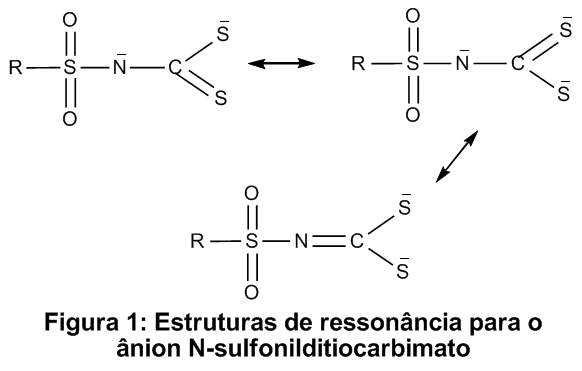
ditiocarbimato precursor. Quando ocorre a formação do complexo, a estrutura de
ressonância (III) (Fig.1) tem uma importância maior, ou seja, o caráter de dupla
ligação de C=N aumenta, ao passo que as ligações do grupo CS2 são do
tipo simples. Isso explica o deslocamento das bandas de C=N para maiores números
de onda e de CS2 para menores números de onda. Os espectros de
1H RMN dos compostos 1-5 apresentaram os sinais esperados para os
átomos de hidrogênio do cátion e do ânion e as curvas de integração estão
consistentes com a proporção 1:1 entre os cátions tetrafenilfosfônio e o ânion
complexo. Os espectros de RMN 13C apresentaram os quatro dupletos
esperados para o cátion tetrafenilfosfônio na região aromática (ALVES, 2009). Os
quatro sinais dos átomos de carbono do trifenilestanho estão condizentes com o
encontrado na literatura (HOLECEK, 1983). Os espectros de RMN 119Sn
de 1-5 apresentaram sinais nas faixas de δ -75,60 a -80,36 e δ -165,23 a
-170,39, indicando números de coordenação quatro e cinco ao centro metálico
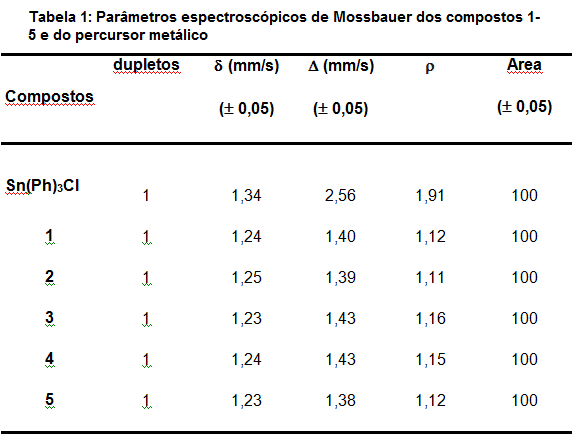
(DIAS, 2012). Os espectros de 119Sn Mössbauer indicaram número de
oxidação +4 (BITZER, 2005) e coordenação igual a 4 (ENG, 2003)(Tab. 1)
Conclusões
Cinco triorganoestânicos com ditiocarbimatos foram síntetizados. As frequências de vibração das ligações C=N e CS2 deslocaram para maior e menor números de onda respectivamente, em comparação ao ligante livre. Os espectros de RMN de 13C apresentaram os sinais esperados para o cátion tetrafenilfosfônio e para o ânion complexo e as curvas de integração nos espectros de RMN de 1H estão consistentes com a proporção 1:1 cátion/ánion. 119Sn Mossbauer indicou número de coordenação e estado de oxidação +4 para Sn e 119Sn RMN indicou um equilíbrio dinâmico entre espécies tetra e pentacoordenada
Agradecimentos
A Universidade Federal de Viçosa À FAPEMIG
Referências
ALVES, L.C.; RUBINGER, M.M.M.; LINDEMMAN, R.H.; PERPÉTUO, G.J.; JANCZAK, J.; MIRANDA, L.D.L.; ZAMBOLIM, L.; OLIVEIRA, M.R.L, Journal of Inorganic Biochemistry 103 (2009) 1045.
BITZER, R. S.; TELES, W. M.; ABRAS, A.; ARDISSON, J. D.; FILGUEIRAS, C. A. L, Journal of the Brazilian Chemical Society, 12 (2005) 963.
DIAS, L. C.; RUBINGER, M. M. M.; BAROLLI, J. P.; ARDISSON, J. D.; MENDES, I. C; LIMA, G. M.; ZAMBOLIM, L.; OLIVEIRA, M. R. L, Polyhedron. 47 (2012) 30.
ENG, G.; SONG, X.; DUONG, Q.; STRICKMAN, J. G.; MAY, L, Applied Orgnanometallic Chemistry, 17 (2003) 218.
GEARY, W. J., Coordination Chemistry Review. 7 (1971) 81.
GIELEN, M, Coordination Chemistry. Reviews. 151 (1996) 41.
HEARD, P. L., Progress in Inorganic Chemistry. 53 (2005) 1.
HOCH, M, Applied Geochemistry. 16 (2001) 719.
HOLECEK, J.; NADVORNIK, M.; HANDLIR, K, Journal of Organometallic Chemistry. 241 (1983) 177.
HUMMEL, H. U.; Korn, Z. Naturforsch. 44 (1989) 24.
TSANGARIS, J.M.; WILLIAMS, D.R, Applied Organometallic Chemistry. 6 (1992) 3.










