ISBN 978-85-85905-10-1
Área
Química Inorgânica
Autores
Bottega, F.C. (UFV) ; Oliveira, M.R.L. (UFV) ; Rubinger, M.M.M. (UFV) ; Bellato, C.R. (UFV)
Resumo
Este trabalho consistiu na síntese, caracterização e atividade biológica de dois sais constituídos de ânions complexos de Sn(IV) com ditiocarbimatos e cátions complexos de Fe(II) com 1,10-fenantrolina de fórmula geral: [Fe(fen)3] [Sn(Bu)2(RSO2N=CS2)2] onde fen = 1,10-fenantrolina, R= CH3(1), C2H5(2) e Bu= n-butil. Os compostos foram caracterizados por espectroscopias de absorção atômica, vibracional, de ressonância magnética nuclear de 1H, 13C. Também foram realizadas medidas de condutância eletrolítica. Os espectros de RMN de 1H e 13C apresentaram os sinais esperados para cátions e ânions. As condutividades molares foram consistentes com a proporção 1:1 cátion/ânion. Foram avaliadas as atividades dos novos compostos frente o fungo Botrytis cinerea
Palavras chaves
Ditiocarbimatos; organoestânicos; diclorobis-n-butilestanho
Introdução
Os ditiocarbamatos e derivados estão entre os fungicidas mais utilizados na agricultura, pois promovem um eficaz controle de fungos patogênicos e apresentam toxidade relativamente baixa. Além da atividade fungicida, apresentam ampla aplicação industrial, podendo ser utilizados como aceleradores de vulcanização (MARIANO, 2008; CUNHA,2008) agentes antibacterianos e anticancerígenos (SADAF, 2008; MENEZES, 2005). Os ditiocarbamato são compostos estruturalmente semelhantes aos ditiocarbimatos. A literatura reporta a atividade antifúngica de sais de tetrafenilfosfônio com complexos aniônicos de zinco com ditiocarbimatos derivados de sulfonamidas (ALVES, 2009). Também foi observada a atividade de sais de ditiocarbimatos de zinco contendo o cátion complexo [Fe(fen)3]2+, onde fen = 1,10-fenantrolina (BOTTEGA, 2013). Em relação aos complexos de estanho com ditiocarbimatos, a literatura relata que sais de fórmula geral (Ph4P)2[Sn(Bu)2(4-RC6H4SO2N=CS2)2] sendo R = F, Cl, Br, I e H são ativos frente o fungo Colletotrichum gloesporioides (DIAS, 2012). Botrytis cinerea, causador da doença mofo cinzento em morangos, é uma espécie de fungo conhecida por atacar diversas espécies de vegetais e em diversas fases de desenvolvimento, tanto vegetativo como reprodutivo, podendo atacar plantas novas bem como as flores e frutos (LISBOA, 2007).Este trabalho consistiu na síntese e caracterização de dois sais contendo ânions complexos de Sn(IV) com ditiocarbimatos, com cátions complexos de Fe(II) com 1,10-fenantrolina Os compostos foram caracterizados por espectroscopias de IV, RMN de 1H, 13C e, absorção atômica e condutividade molar. Foram investigadas as atividades antifúngicas dos novos compostos frente o fungo Botrytis cinerea.
Material e métodos
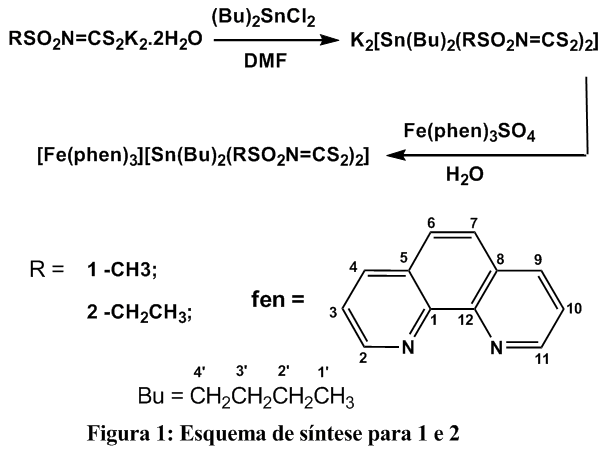
Foram sintetizados dois novos compostos de fórmula geral [Fe(fen)3] [Sn(Bu)2(RSO2N=CS2)2] onde fen = 1,10-fenantrolina, R= CH3 (1), C2H5 (2) e Bu = n-butil. Os ditiocarbimatos de potássio foram sintetizados a partir das sulfonamidas apropriadas em reação com dissulfeto de carbono e hidróxido de potássio, de acordo com a literatura (FRANCA, 2006; HUMMEL, 1989). Os compostos 1 e 2 foram preparados de acordo com metodologia aplicada na síntese de compostos semelhantes (BOTTEGA, 2013), [Fe(fen)3]SO4 foi sintetizado a partir da reação de 0,7 mmol de sulfato ferroso amoniacal hexa-hidratado e 2,1 mmol de 1,10-fenantrolina em 10 mL de água destilada sob agitação de 3 horas. Diclorobis-n-butilestanho(IV) (0,7 mmol) e o sal N-R-sulfonilditiocarbimato diidratado (1,5mmol) foram adicionados em dimetilformamida (15mL), a mistura ficou sob agitação por 1 hora e 30 minutos e em seguida foi filtrada. As duas soluções foram misturadas e mantidas sob agitação por 1 hora em banho de gelo. Os compostos obtidos foram lavados com água destilada, álcool dietílico e éter etílico e secos a pressão reduzida. Os rendimentos para 1 e 2 foram de 61,4 e 81,6, respectivamente. Para todos os compostos foram determinadas as faixas de fusão (aparelho Microquímica MQAPF-302 Mettler FP% sem correção), condutividade molar (solução de DMF a 25°C com aparelho Jenway 4010 Conductivity Meter) e obtidos espectros no infravermelho (espectrofotômetro Perkin Elmer FT-IR 1000). Os espectros de RMN de 1H (300 MHz) e de 13C (75 MHz) foram obtidos em espectrômetro VARIAN (MERCURY 300) em DMSO-D6 com TMS como padrão interno. A avaliação da atividade fungicida frente ao fungo Botrytis cinérea, foi realizada pelo método poison food (SRIDHAR, 2003).
Resultado e discussão
A Figura 1 apresenta a rota síntese para a obtenção dos novos compostos. Os
compostos 1 e 2 são sólidos de coloração vermelho, solúveis em dimetilsulfóxido
e dimetilformamida. Os espectros no infravermelho mostraram três bandas na
faixa de 1585-1438 cm-1 atribuídas aos estiramentos das ligações de C=C e N=N
dos anéis aromáticos de 1,10-fenantrolina. As bandas médias ou fortes na região
de 1320 a 1340 cm-1 foram atribuídas ao estiramento da ligação C=N do grupo
ditiocarbimato (OLIVEIRA,2008). As bandas observadas na região de 900 a 1000 cm-
1 correspondem ao estiramento assimétrico CS2. Segundo a literatura, a banda de
estiramento simétrico CS2 do grupo ditiocarbimato deveria ser deslocar para
menores número de onda e a de estiramento C=N para maiores números de onda após
a complexação via dois átomos de enxofre (OLIVEIRA, 2003). Para os compostos
aqui descritos isso não foi observado no caso da banda ʋCS2 que não se deslocou,
porém observou-se o desdobramento dessa banda. Os espectros de RMN 13C
apresentaram seis sinais correspondentes ao cátion tris(1,10-
fenantrolina)ferro(II)(MUDASIR, 1999). Segundo a literatura os sinais dos átomos
de carbono C4’, C3’, C2’ e C1’ de grupos butila ligados ao estanho aparecem em
torno de 27,60, 27,60, 26,12 e 13,35 ppm (HOLECEK 1983). Esses valores estão
condizentes com aqueles observados nos espectros. Os espectros de RMN 1H dos 2
compostos mostraram os sinais de H alifáticos e aromáticos. As curvas de
integração estão consistentes com a proporção 2:1 cátion:ânion. Fe e Sn
apresentaram os % esperados na análise de absorção. Os dois compostos apresentam
atividade fungicida frente à espécie B. cinerea. Os percentuais de inibição
encontrados foram: 1, 0,01mmol/L = 26,50% e 0,2mmol/L = 87,66%; 2, 0,01mmol/L =
28,50% e 0,2mmol/L = 86,60
Conclusões
Os compostos 1 e 2 foram caracterizados por IV, RMN 1H e 13C e condutância eletrolítica. Os números de onda da vibração da ligação C=N observada nos espectros dos compostos são maiores do que a observada para os ligantes livres, indicando a complexação dos ânions ditiocarbimatos. Os espectros de RMN apresentaram os sinais esperados para cátions e ânion. Os valores encontrados na análise de condutância eletrolítica confirmam a proporção 2:1 ânion/cátion. Todos os compostos foram ativos frente a espécie B. cinérea
Agradecimentos
Ao departamento de Química e fitopatologia da UFV e À FAPEMIG
Referências
ALVES, L. C.; Rubinger, M. M. M.; Lindemann, R. H.; Perpétuo, G. J.; Janczak, J.; Miranda, L. D. L., Zambolim, L.; Oliveira, M. R. L., Journal of Inorganic Biochemisty. 103 (2009) 1045.
BOTTEGA, F. C.; OLIVEIRA, M. R. L.; GARCIA, C. V.; RUBINGER, M. M. M.; MENEZES, D. C.; ZAMBOLIM, L, Química Nova. 36 (2013) 803.
CUNHA, L.M.G.; RUBINGER, M.M.M.; OLIVEIRA, M.R.L.; SABINO, J.R., Acta Crystallographica, 64 (2008) 148.
DIAS, L. C.; RUBINGER, M. M. M.; BAROLLI, J. P.; ARDISSON, J. D.; MENDES, I. C; LIMA, G. M.; ZAMBOLIM, L.; OLIVEIRA, M. R. L, Polyhedron. 47 (2012) 30.
FRANCA, E. F.; OLIVEIRA, M. R. L.; GUILARDI, S.; ANDRADE, R. P.; LINDEMANN, R. H.; AMIM, J.; ELLENA, J.; DE BELLIS, V. M.; RUBINGER, M. M. M. Polyhedron, 25 (2006) 2119.
HOLECEK, J.; NADVORNIK, M.; HANDLIR, K, Journal of Organometallic Chemistry. 241 (1983) 177.
HUMMEL, H. U.; Korn, Z. Naturforsch. 44 (1989) 24.
LISBOA, B. B.; BROCHESE, C. C.; VARGAS, L. K.; SILVEIRA, J, R. P.; RADIN, B.; OLIVEIRA, A. M. R. Ciência Rural, 37 (2007) 1255.
MARIANO, R.M. et al. Journal of Applied Polymer Science, 110 (2008) 1938.
MENEZES, D. C.; VIEIRA, F. T.; DE LIMA, G. M.; PORTO, A. O.; CORTES, M. E.;
ARDISSON J. D.; ALBRECHT-SCHMITT, T. E, European Journal of Medicinal Chemistry. 40 (2005) 1277.
MUDASIR; Yoshioka, N.; Inoue, H.; Transition Metal Chemistry. 24 (1999) 210.
OLIVEIRA, M. R. L.; AMIM, J.; SOARES, I. A.; DE BELLIS, V. M.; DE SIMONE, C. A.; NOVAIS, C.; GUILARDI, S; Polyhedron, 27 (2008) 727
OLIVEIRA,M. R. L.; DINIZ, R. D.; DE BELLIS, V. M.; FERNANDES, N. G.; Polyhedron, 22 (2003) 1561.
SADAF, K.; SHAHAB, A.A.; NAMI, K.S.S.; Journal of Organometallic Chemistry, 693 (2008) 1049.
SRIDHAR, S. R.; RAJAGOPAL, R. V, J. Agric. Food Chem. 51 ( 2003) 7596.










