ISBN 978-85-85905-10-1
Área
Química Inorgânica
Autores
Santos, R.D. (UFRJ) ; Moura, F.S. (UFRJ) ; Rego, G.S. (UFRJ) ; Medeiros, M.E. (UFRJ) ; Garrido, F.M.S. (UFRJ) ; Casellato, A. (UFRJ)
Resumo
A tecnologia das pilhas a combustível vem se mostrando uma alternativa promissora de geração de energia frente às fontes convencionais. Uma pilha a combustível é um dispositivo eletroquímico que produz energia elétrica a partir de uma reação química por um mecanismo de conversão de energia eficiente e não poluente. Nestes dispositivos se faz necessário o uso de eletrocatalisadores, principalmente devido à cinética lenta apresentada pela reação de redução do oxigênio molecular (RRO). Muitos compostos de coordenação têm sido estudados suportados em materiais de alta área superficial para utilização como eletrodos nestes dispositivos. Neste trabalho um complexo de níquel foi suportado em Vulcan X 72R, caracterizado por diferentes técnicas e testes preliminares frente a RRO foram realizados
Palavras chaves
PILHA A COMBUSTÍVEL; COMPLEXO DE NÍQUEL; REDUÇÃO OXIGÊNIO
Introdução
As tecnologias atuais de geração de energia, baseadas na combustão, são prejudiciais ao meio ambiente e contribuem para diversos problemas ambientais como alterações climáticas. A tecnologia das pilhas a combustível vêm se mostrado uma alternativa promissora de geração de energia frente às fontes convencionais, pois produzem energia elétrica a partir de uma reação química por um mecanismo não poluente e que apresenta alta eficiência.1,2 Existem diferentes tipos de pilhas a combustível, entretanto, todas operam com o mesmo princípio básico e são constituídas por dois eletrodos porosos separados por um eletrólito. Nestes dispositivos o principal composto utilizado como combustível é o gás hidrogênio e como oxidante o gás oxigênio. A cinética lenta apresentada pela reação de redução do oxigênio molecular (RRO) torna necessário a utilização de eletrocatalisadores e desempenha um papel fundamental no funcionamento destes dispositivos. 2,3,4 Muitos materiais vêm sendo estudados como possíveis eletrocatalisadores, entre eles compostos de coordenação que apresentam ligantes N-doadores.Para utilização como eletrodos, estes estes compostos são suportados em materiais de alta área superficial, como o Vulcan X 72R.5,6,7,8 Entretanto, o desempenho eletrocatalítico e a estabilidade destes materiais depende de diversos fatores como, por exemplo, método de síntese, estrutura dos ligantes e tipo de suporte empregado. Desta forma, o objetivo deste trabalho consistiu testar rotas para suportar de um complexo de níquel em Vulcan X 72R, caracterizar os materiais obtidos por diferentes técnicas, como DRX-pó, IV e voltametria cíclica. Além disso, foram realizados testes preliminares dos materiais frente a reações de redução de oxigênio em meio básico.
Material e métodos
O complexo de níquel NiHBGi, Fig 1b, foi suportado ao Vulcan X 72R, na proporção 1:1 em massa, utilizando duas rotas onde foi alterada a ordem de adição deste suporte durante a síntese do complexo. Na primeira metodologia, o complexo foi sintetizado a partir de uma solução metanólica contendo 2,12 x 10-3 mol de glicina a qual foi adicionada 2,12 x 10-3 mol de salicilaldeído. Em seguida 2,12 x 10-3 mol de acetato de níquel foi adicionado, permanecendo sob agitação magnética durante 30min. Em seguida o Vulcan X 72R, 0,5g, foi adicionado a solução e esta mantida a 40°C durante 30 minutos e sonicada sob a mesma temperatura por mais 30 minutos. O material foi seco por evaporação do solvente e mantido em dessecador( C_Ni_I). A segunda metodologia consistiu adicionar o Vulcan X 72R após a síntese do ligante, assim a 2,12 x 10-3 mol de glicina solubilizada em metanol foi adicionado 2,12 x 10-3 de salicilaldeído, e 0,5g do suporte foi adicionado. A solução foi aquecida a 40°C durante 30 minutos. Após este período, 2,12 x 10-3mol de acetato de níquel foi adicionado a solução, permanecendo nas mesmas condições durante 30 minutos e sonicada a 40ºC durante 30 minutos. O material foi isolado pela evaporação do solvente e guardado em dessecador (C_Ni_II).Os materiais obtidos foram caracterizados pelas técnicas de difração de raios-X, método do pó, espectroscopia de infravermelho. A caracterização eletroquímica e os testes preliminares de atividade foram realizados sob atmosfera de N2 e O2,respectivamente, utilizando um eletrodo de pasta de carbono em uma cela voltamétrica com o sistema de três eletrodos,KCl 0,5 molL-1 como eletrólito suporte ajustando o pH em 13 com solução de KOH.
Resultado e discussão
Os espectros no infravermelho na região de 4000 - 400 cm-1dos
materiais C_Ni_I e C_Ni_II foram obtidos e comprados aos espectros do complexo e
o ligante. Foram observados, tanto para o C_Ni_I quanto para o C_Ni_II,
espectros semelhantes ao obtido para o complexo isolado, apresentando bandas de
absorção características como as de grupamentos imina (1599 cm-1),
fenol (1287cm-1) e carbonila (1656 cm-1e 1323
cm-1)deslocadas em relação ao espectro do ligante isolado sugerindo
que em ambos os casos houve a formação do complexo. Os materiais suportados
apresentam um padrão de difração similar ao do complexo, como pode ser
observado na Figura 2. O material C_Ni_I apresenta os picos deslocados para
valores menores de 2θ, quando comparado aos valores obtidos para o complexo
isolado, de forma que alguns picos não são observados e além disso é possível
verificar a presença de picos relacionados ao ligante, sugerindo que não houve a
complexação total. O mesmo deslocamento é observado para o C_Ni_II, entretanto
este é menos significativo, e nesta amostra apenas os picos característicos do
complexo foram verificados. A caracterização eletroquímica do complexo em
atmosfera de nitrogênio mostra um processo redox com potencial de pico anódico,
Epa (V) vs ECS, em 0,80V e um pico de redução com potencial de pico catódico,
Epc (V) vs. ECS, em -0,04V relacionados ao par redox NiII/NiIII. Em presença de
oxigênio o pico anódico não é verificado e a pico catódico é deslocado para
valores mais positivos, Epc (V) vs. ECS, em -0,01V, e apresenta um valor mais
elevado de corrente. O aparecimento de um novo pico catódico, Epc (V) vs. ECS,
em -0,51V, o qual pode ser atribuído à reação de redução do oxigênio.
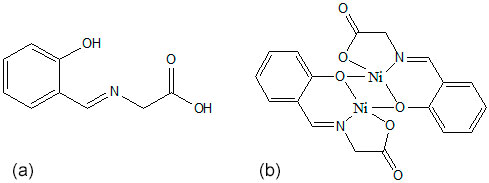
(a) Estrutura do ligante HBGi e (b) estrutura proposta para o complexo NiHBGi
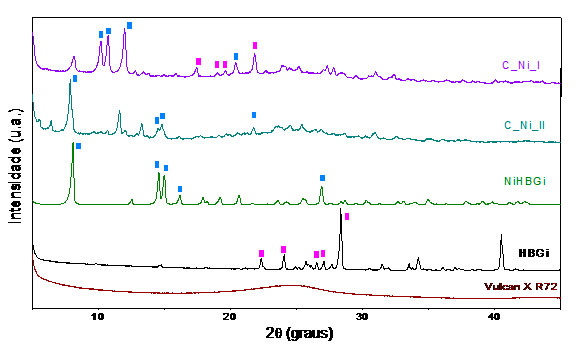
Difratogramas de raios X, método do pó, dos materiais suportados C_Ni_I e C_Ni_II, complexo isolado, ligante e Vulcan X 72R.
Conclusões
Duas rotas de impregnação de complexos em Vulcan X R72 foram testadas. Os materiais obtidos foram caracterizados apresentando espectros no infravermelho similares ao complexo isolado, evidenciando a complexação. Entretanto, pelo padrão de raio X obtido para o material C_Ni_I é possível verificar a presença de picos similares ao do ligante, indicando que a complexação não foi completa. Testes eletroquímicos preliminares mostraram que este composto apresenta comportamento eletrocatalítico em em reações de redução de oxigênio em meio básico.
Agradecimentos
Instituto de Química/UFRJ; Programa de Pós-Graduação em Química - PGQu/UFRJ; CAPES/CNPq; FAPERJ; PIBIC/UFRJ
Referências
[1]MEKHILEFA,S.;SAIDUR,R.;SAFARI,A. Comparative study of different fuel cell Technologies. Renewable and Sustainable Energy Reviews, v.16, p.981-989, 2012. [2]SHARAF,O.Z.;ORHAN,M.F. An overview of fuel cell technology: Fundamentals and applications Sustainable Energy Reviews, v.32, p.810-853, 2014 [3]GEWIRTH,A.A.;THORUM,M.S. Electroreduction of Dioxygen for Fuel-Cell Applications: Materials and Challenges. Inorganic Chemistry, V. 49, p. 3557–3566, 2010 [4]BEZERRA,C.W.B.;ZHANG,L.;LEE,K.;LIU,H.;MARQUES,A.L.B.;MARQUES,E.P.;WANG,H.;ZHANG,J. A review of Fe-N/C and Co-N/C catalysts for the oxygen reduction reaction. Electrochimica Acta, v. 53, p. 4937-4951, 2008. [5]MA,Y.;WANG,H.;JI,S.;GOH,J.;FENG,H.;WANG, R.; Highly active Vulcan carbon composite for oxygen reduction reactionin alkaline medium, Electrochimica Acta, v. 133, p. 391–398, 2014. [6]GAN,T.;JIANG,Q.;ZHANG,H.;WANG,W.;LIAO,X.Z.;MA,Z. Study on the membrane electrode assembly fabrication with carbon supported cobalt triethylenetetramine as cathode catalyst for proton exchange membrane fuel cell. Journal of Power Sources, v. 196, p 1899–1903, 2011. [7]OH,J.;YOO,E.;ONO,C.;KIZUKA,T.;OKADA,T.;NAKAMURA,J. Support effect of anode Catalysts using an organic metal complex for fuel cells. Journal of Power Sources, v.185, p. 886–891, 2008. [8]SANETUNTIKUL,J.;SHANMUGAM,S. Prussian Blue-Carbon Hybrid as a Non-Precious Electrocatalyst for the Oxygen Reduction Reaction in Alkaline Medium. Electrochimica Acta , v.119, p. 92–98, 2014.










