ISBN 978-85-85905-10-1
Área
Química Inorgânica
Autores
de Souza Rego, G. (UFRJ) ; Moura, F. (UFRJ) ; Dias, R. (UFRJ) ; Casellato, A. (UFRJ) ; Medeiros, M. (UFRJ) ; Garrido, F. (UFRJ)
Resumo
Viabilizando uma forma de gerar energia elétrica sem causar danos ao meio ambiente, ultimamente tem-se pesquisado mais a respeito de pilhas a combustível. Porém,esses dispositivos necessitam de eletrocatalisadores.O principal eletrocatalisador utilizado recentemente é a platina,sendo esta de alto custo. Por isso,outros compostos de custo mais baixo vem sido testados como possíveis eletrocatalisadores,destacando-se os compostos de coordenação.A fim de contribuir para as pesquisas nesse âmbito,um complexo de cobre foi sintetizado e caracterizado pelas técnicas de voltametria cíclica,espectrometria nas regiões do infravermelho e do UV-vis,teste de condutividade elétrica e ponto de fusão. Foram obtidos resultados favoráveis,o que permitirá estudos mais aprofundados deste composto nas pilhas.
Palavras chaves
eletrocatalisador; pilha a combustível; complexo
Introdução
Na tentativa de gerar energia elétrica de forma que não haja dependência da utilização de combustíveis fósseis, que geram gases poluentes prejudiciais ao meio ambiente, como o CO2 principal causador do efeito estufa, as células a combustível tem se apresentado como possível substituinte para a geração de energia elétrica, pois estas geram resíduos menos poluentes e possuem alta eficiência. As células a combustível são dispositivos capazes de converter a energia gerada por uma reação química em energia elétrica. Esses dispositivos utilizam como oxidante o oxigênio porém, como as reações químicas envolvidas na redução deste composto não são energeticamente favoráveis, sendo necessário o uso de eletrocatalisadores. Ultimamente, a platina tem sido o principal eletrocatalisador utilizado. Pelo fato da platina ser um metal caro, por oxidar o carbono e possuir baixa durabilidade, outros compostos vem sido testados como possíveis eletrocatalisadores que possam substituí-la. Dentre eles destacam-se compostos de coordenação macrocíclicos que contenham nitrogênio em sua composição, pois estes apresentam um menor custo.(SANETUNTIKUL/SHANMUGAM,2013) Alguns já até tem sido utilizados como eletrocatalisadores como [Co(salen)], poli(Fe-salen) e o [V(salen)](QUINTELA, 2013). Dentro deste contexto, o objetivo deste trabalho é sintetizar e caracterizar o complexo de cobre a fim de que este possa atuar como um possível eletrocatalisador nas reações de redução do oxigênio em meio alcalino.
Material e métodos
Para síntese do ligante, foi utilizado 0,0134 mol de glicina solubilizados em KOH alcoólico (metanol) seguida da adição de 0,014 mol de salicilaldeído gota-a-gota . A reação foi mantida sob agitação magnética constante durante 90 minutos. Após este período, uma solução metanólica contendo 0,015 mol de acetato de cobre(II) foi adicionada lentamente, para síntese do complexo in situ (ou seja, sem que o ligante tenha sido isolado previamente). Foi obtido um sólido verde, o qual foi seco em dessecador. O ligante livre já foi caracterizado previamente e está descrito em outros trabalhos do grupo(Dias,2012).O complexo foi caracterizado no estado sólido descrita por espectroscopia na região do infravermelho e ponto de fusão. Já em solução, o complexo teve seu comportamento estudado em metanol através de condutividade elétrica, espectroscopia eletrônica e voltametria cíclica. Os espectros do infravermelho foram obtidos utilizando espectrofotômetro de infravermelho por transformada de Fourier (FTIR) Nicolet Magna –IR 760 na região de 600-150 cm-1 (FAR) e 4000-400 cm-1. As análises condutométricas foram realizadas em solução de 1mmol/L e termostatizadas a 25°C utilizando o condutivímetro Analyser microprocessado, modelo 650 M.O estudo na região do UV-vis foi avaliado entre 200-1100 mn utilizando-se soluções em várias concentrações na faixa de 10-3 – 9,87x10-6 M em cubetas de 3 mL e foram úteis para a atribuir as bandas referentes às transições eletrônicas no complexo. A caracterização eletroquímica através de voltametria cíclica foi realizada em uma cela voltamétrica que consiste em um sistema de três eletrodos: o de trabalho, o de referência e contra eletrodo um fio de platina.Como eletrólito suporte foi utilizado TBAPF6 e o pH solução não foi alterado.
Resultado e discussão
No espectro de iv do ligante observaram-se várias bandas,onde destacam-se os grupos fenol,imina e ácido carboxílico(SILVERSTEIN,2005).Quanto ao espectro do complexo,podem ser notadas diferenças em relação ao do ligante devido à complexação do Cu+2,por exemplo,a banda da carbonila do ácido em 1724cm-1 no espectro do ligante foi deslocada para 1650cm-1 no do complexo.A ligação C=N em 1618cm-1 no espectro do ligante foi para 1601cm-1 no do complexo(SILVERSTEIN,2005).As bandas das hidroxilas do ácido e do fenol não podem ser diferenciadas no espectro do complexo,apenas uma banda alargada é observada em 3444cm-1 e pode estar relacionada com a presença de água no solvente utilizado para análise(GUZZI,S;ALAGI,H,2013).O espectro na região do iv distante do complexo apresenta mais bandas do que o do ligante devido às interações metal-ligante,sendo estas Cu-N e Cu-O(NAKAMOTO,1986).No estudo do ponto de fusão do complexo observou-se que este apresentou uma mudança de cor em torno de 200°C passando de verde para marrom,indicando uma possível alteração estrutural ou degradação.O espectro eletrônico apresentou uma banda em torno de 651nm(AL-SHAALAN H,2011)(ε=78,4850Lmol-1cm-1)de baixa intensidade podendo ser atribuída a uma transição d-d do metal.O teste de condutividade apresentou 85,35µS,sugerindo um complexo neutro.O estudo eletroquímico apresentou um perfil não-reversível(Moreno,2011)contendo dois picos de oxidação com potencial de pico anódico em 0,73V e 1,57V e dois picos de redução com potencial de pico catódico, em -0,97V e -1,28V.(BUSSI,2014).As ondas podem ser atribuídas aos processos Cu2+,Cu2+/Cu+,Cu2+ e Cu+,Cu2+/Cu+,Cu+.A diferença nos potenciais redox dos íons pode relacionar-se à hidrolise incompleta da ponte acetato proposta na estrutura do complexo.
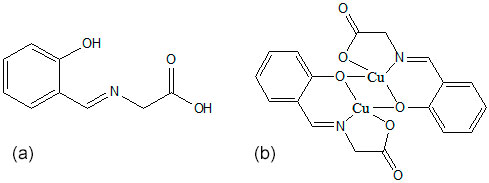
a- ligante; b- provável estrutura do complexo
Conclusões
O complexo de Cu+2 foi sintetizado e caracterizado pelas diversas técnicas espectroscópicas e eletroquímicas buscando-se correlaciona-las com a estrutura de outros complexos descritos pelo grupo. Com base nesses resultados, o complexo descrito nesse trabalho é isoestrutural ao descrito por Santos, R. D.[4] A partir da completa caracterização do complexo, novos estudos vem sendo realizados para aplicação dele como eletrocatalisador em células a combustível.
Agradecimentos
Referências
SANETUNTIKUL J; SHANMUGAM S. “Prussian Ble-Carbon Hybrid as a Non-Precious Eletrocatalyst for the Oxygen Reduction Reaction in Alkaline Medium”.Elsevier, Electrochimica Acta, Department of Energy Systems Engeneering, Daegu, República da Korea, 2013
QUINTELA S. “ Síntese, eletropolimerização e atividade eletrocatalítica de derivados de Salen” Dissertação de mestrado, 2013.
DIAS, R. “ Síntese e caracterização de materiais nanoestruturados contendo níquel para a utilização em pilhas a combustível. Dissertação de mestrado- Programa de pós graduação em Química. 117p. Rio de Janeiro: UFRJ, 2012
SILVERSTEIN, R.M, BASSLER, G.C; MORRIL, T.C. “Systematic Identification of Organic Compounds”, J. Wiley, Nova York, 2005
GUZZI, S; ALAGI, H. “Synthesis, characterization and antimicrobial studies on nickel(II) and copper(II) complexes of 2N2O2 donor Schiff base.”Pelagia Research Library, Chemistry Department, Faculty of Science, University of Benghazi, Benghazi, Líbia 2013.
NAKAMOTO K. “Infrared and Raman Spectra of Inorganic and Coordenation Compounds”, quarta edição, J. Wiley, Nova York, 1986
AL-SHAALAN NORA H. “Synthesis, Caracterization and Biological Activities of Cu(II), Co(II), Mn(II), Fe(II) and UO2(VI) Complexes with a New Schiff Base Hydrazone: O-Hydroxyacetophenona-7-chloro-4-quinoline Hydrazone.”Organic Synthesis, Arábia Saudita, Outubro de 2011.
MORENO, P.”Estudos eletroquímicos de complexos de cobre(II) de antibióticos da classe das fluorquinolonas”. Dissertação de mestrado, UFMG, Belo Horizonte, 2011.
BUSSI, G. “Investigação da promiscuidade catalítica de novos complexos metálicos”. Dissertação de mestrado, Rio de Janeiro, Março de 2014.










