ISBN 978-85-85905-10-1
Área
Físico-Química
Autores
Ferro, E.C. (UEMS) ; Arruda, G.J. (UEMS)
Resumo
Este trabalho apresenta uma avaliação do efeito do surfactante aniônico dodecil sulfato de sódio (SDS) na redução da trifluralina, utilizando como método eletroquímico a voltametria de onda quadrada (SWV), voltametria cíclica (VC) e espectroscopia de impedância eletroquímica (EIE), em eletrólito de suporte, H2SO4 0,02 mol L-1 e solução K3[Fe(CN) 6], 1 mmol L-1, utilizando eletrodo de carbono vítreo como eletrodo de trabalho. Os resultados obtidos mostraram que a presença de surfactante aumenta a intensidade de corrente de pico de redução da trifluralina em mais de 140%. A presença de surfactante diminui em mais de 35% a resistência da transferência de carga, favorecendo o processo redox.
Palavras chaves
Surfactante; Impedância Eletroquímica; Trifluralina
Introdução
A trifluralina é um herbicida pré-emergente de nome químico α,α,α-trifluoro-2,6- dinitro-N,N-dipropil-p-toluidina (TRF) pertencente ao grupo das dinitroanilinas, é indicado para o controle de ervas daninhas em uma ampla variedade de culturas agrícolas sendo considerado mediamente tóxico (ANVISA, 2010). Em meio ácido, a TRF apresenta um pico de redução, que é atribuído a redução de grupos nitros presente em sua estrutura molecular (KOTOUCEK, M. et al., 1996). Surfactantes são moléculas anfipáticas constituídas de uma porção hidrofóbica e uma porção hidrofílica. A porção apolar é frequentemente uma cadeia de hidrocarboneto, enquanto a porção polar pode ser iônica (aniônica ou catiônica), não-iônica ou anfótera. Devido as suas propriedades físico-químicas os surfactantes são utilizados na eletroquímica para auxiliar na formação de ambientes micelares na superfície do eletrodo, favorecendo a transferência de carga entre a superfície do eletrodo e a solução (MANIASSO, 2001). O objetivo deste trabalho foi avaliar a influência do surfactante aniônico SDS sobre a corrente e potencial de pico de redução de grupos nitro da trifluralina, utilizando eletrodo de carbono vítreo (CV) como eletrodo de trabalho e como método eletroquímico as voltametrias SWV e VC, e a espectroscopia de impedância eletroquímica (EIE).
Material e métodos
As medidas eletroquímicas foram realizadas em um Potenciostato/Galvanostato AUTOLAB PGSTAT 128N interfaciado a um computador e gerenciado pelo software NOVA 1.10 para aquisição e tratamento dos dados. O eletrodo de carbono vítreo foi previamente limpo em feltro umedecido com solução de alumina 0,3 µM numa politriz e levado em banho ultrassônico em álcool etílico absoluto (99,8%), água destilada e ácido nítrico (HNO3) 0,1% respectivamente, durante 3 minutos em cada etapa em lavadora ultrassônica L-100 (SCHUSTER). Foi utilizada uma célula eletroquímica com 3 eletrodos e capacidade de 25 mL para as medidas. Os eletrodos de fio de platina, (Ag/AgCl) e eletrodo de carbono vítreo com área geométrica de 0,0804 cm2, foram utilizados como eletrodo auxiliar, referência e de trabalho, respectivamente. Os voltamogramas foram obtidos após 10 minutos de purga de nitrogênio com pureza de 99,999%. Reagentes: A solução estoque de trifluralina foi preparada através da diluição do padrão analítico (Sigma-Aldrich) com 99,1% de pureza em etanol absoluto (99,8%). Para as medidas eletroquímicas em SWV foram adicionados em 5 mL do eletrólito de suporte (H2SO4 0,02 mol L-1), 3 µL de SDS à 0,998 mol L-1 e 0,1 mL de uma solução de trifluralina à 3,01x10-3 mol L-1, obtendo assim uma concentração de 58,98 x 10-6 mol L-1 de trifluralina e 58,67x10-6 mol L-1 de SDS na célula, e para as medidas eletroquímicas em CV e EIE foram adicionados em 5 mL do eletrólito de suporte, 3 µL de SDS e 0,1 mL de solução de K3[Fe(CN)6] 0,050 mol L-1, obtendo uma concentração de 1 x 10-3 mol L-1 na célula.
Resultado e discussão
Nos SWVs obtidos com e sem adição de SDS, observa-se ausência de pico no
voltamograma do eletrólito e SDS. A presença de trifluralina na célula
eletroquímica apresenta um pico em Ep=-0,36V/Ip=-15,55µA, e em
Ep=-0,46V/Ip=-37,38µA) com a adição do SDS, resultando em um aumento de 140,38%
na intensidade da corrente de pico (Figura 1A). A corrente de pico é
influenciada pelo SDS, devido sua adsorção na superfície do eletrodo de
trabalho, formando agregados micelares e reduzindo a tensão superficial e
interfacial (eletrodo-solução), contribuindo para uma maior sensibilidade e
repetibilidade na corrente do pico de redução da TRF, sendo provavelmente a
estabilização da dupla camada eletrodo-solução (Figura 1B). (CARAMIT, 2012).
Nos VCs obtidos na presença de K3[Fe(CN)6], não observou
diferenças significativas no perfil voltamétrico na ausência e presença de SDS
(Figura 2C), e os EIEs obtidos para a mesma solução na presença e ausência de
SDS estão representados no diagrama de Nyquist (Figura 2D), e o circuito
[Rs(Cdc[RtcZ])], onde Rs resistência da solução, Cdc capacitância da dupla
camada e Rtc resistência de transferência de carga. Os valores de Rtc foram de
17,3kΩ e 12,7kΩ, na presença e ausência de SDS, respectivamente. A constante de
velocidade heterogênea padrão foi estimada através da equação: k0 =
(RT)/(n2F2 A Rtc C), onde R constante universal dos gases,
T temperatura em K, F constante de Faraday, A área do eletrodo, e C concentração
de K3[Fe(CN)6] na célula, obtendo valores de 1,91 e 2,60
cm s-1 na ausência e presença de SDS. A presença de SDS provoca o
aumento em k0 favorecendo a transferência de carga, aumentando a
intensidade da corrente de pico de redução da TRF.
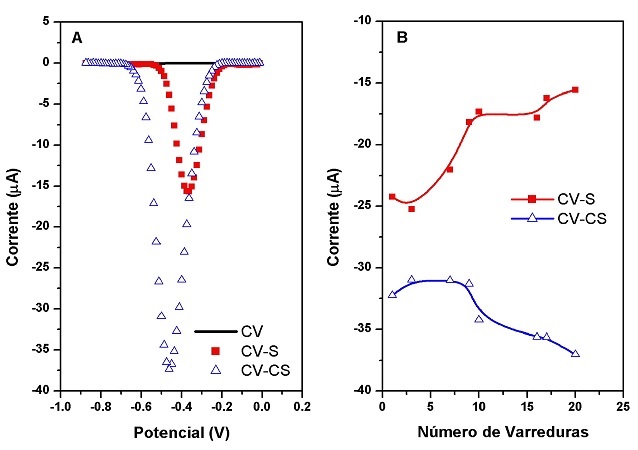
Figura 1. (A) SWV do eletrólito, e [TRF]=58.98µM com e sem SDS. f=80Hz, ∆ep=12mV e a=150mV. (B) Ip versus nº de varreduras.
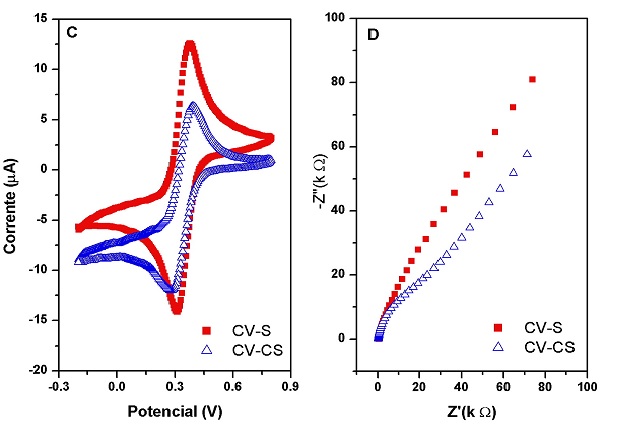
Figura 2. (C)VCs sem(CV-S) e com surfactante SDS (CV-CS) v=100mVs-1. (D) EIE sem(CV-S) e com surfactante SDS.
Conclusões
Os resultados obtidos mostraram que a presença de SDS influencia o processo de redução da trifluralina, diminuindo a resistência da transferência de carga e aumentando a constante de velocidade heterogênea da reação, o que acarreta aumento na corrente de pico de redução. Portanto no desenvolvimento de metodologia eletroquímica para determinar a trifluralina, a presença de surfactante aniônico na célula eletroquímica são indicados, pois provavelmente fornecera um método com melhor desempenho em relação a repetibilidade, reprodutibilidade, limite de detecção e quantificação.
Agradecimentos
UEMS, CNPq e Fundect
Referências
ANVISA, Agência Nacional de Vigilância Sanitária. Resolução RE nº 159 de 19/01/10 índice monográfico T 24. Disponível em: http://portal.anvisa.gov.br/wps/wcm/connect/cf3ae9804745896f93a5d73fbc4c6735/T24++Trifluralina.pdf?MOD=AJPERES
CARAMIT, R. P. Determinação voltamétrica simultânea de Antioxidantes em biodiesel empregando eletrodos Impressos de carbono/nanotubos de carbono. 2012. 64 f. Dissertação (Pós Graduação em Química) - Centro de Ciências Exatas e Tecnologia, Fundação Universidade Federal de Mato Grosso do Sul, Campo Grande. 2012.
KOTOUCEK, M.; OPRAVILOVA, M. 1996. Voltammetric behaviour of some nitropesticides at the mercury drop electrode. Analytica Chimica Acta. 329: 73-81 MOSES, P. R., Wier, L., Murray R. W. "Chemically Modified tin oxide Eletrocde" Anal. Chem.1975 (47), 1822.
MANIASSO, N. Ambientes micelares em química analítica. Química Nova v. 24, n.1, p. 87-93, 2001.
SOUZA, L. L. Uso da voltametria cíclica e da espectroscopia de impedância eletroquímica na determinação da área superficial ativa de eletrodos modificados à base de carbono. 2011. 94 f. Dissertação (Mestrado em Ciências na Área de Tecnologia Nuclear – Materiais) - Instituto de Pesquisas Energéticas e Nucleares, Autarquia associada à Universidade de São Paulo, São Paulo. 2011.










