ISBN 978-85-85905-10-1
Área
Físico-Química
Autores
Dias, V.R. (UEMA) ; Hellmann, T. (UEMA) ; Silva, H.S. (UEMA) ; Ericeira, E.R. (UEMA) ; Costa, M.C.P. (UEMA)
Resumo
As moléculas do gás, ao se movimentarem, colidem com as outras moléculas e com as paredes do recipiente onde se encontram, exercendo uma pressão, aumento de temperatura ou volume, obedecendo a certas leis físico-químicas. No trabalho realizado, são utilizados materiais comuns em um laboratório de química, a fim de criar-se um método de auxílio ao aprendizado de físico-química, desenvolvido no decorrer da disciplina Estudo dos Gases e Termodinâmica, ministrada na Universidade Estadual do Maranhão. Esse estudo visa à comprovação da lei de Charles (p1/p2=T1/T2) a partir da reação entre um metal e ácido forte, numa reação de simples troca, com obtenção do gás hidrogênio, por meio da construção de um protótipo.
Palavras chaves
Lei de Charles; protótipo alternativo; estudo dos gases
Introdução
Nas condições normais de temperatura e pressão, o gás hidrogênio apresenta-se normalmente em sua forma molecular, formando um gás diatômico (H2). Este gás é inodoro, incolor, inflamável, insípido, não-metálico e insolúvel em água (CRUZ, 2010). O hidrogênio muito consumido em diversos processos químicos industriais, como a síntese da amônia, hidrogenação de óleos e gorduras, combustíveis, etc., assim como tem grande importância na formação de componentes bioquímicos vitais ao organismo (ATKINS, 2001). A lei dos gases ideais define-se pelos valores do volume que o gás ocupa, V, da quantidade de substância (número de moles), n, da pressão, p, e da temperatura, T, representada pela equação dos gases ideais, pV=nRT. Neste experimento, é possível obter alguns desses valores a volume constante, chegando a equação para a lei de Charles, (p1/p2=T1/T2). Este trabalho visa a comprovação dessa lei dos gases, por meio da reação de um metal e ácido forte, obtendo o gás hidrogênio, por meio da construção de um protótipo, baseado no modelo de Ericeira (2012).
Material e métodos
Inicialmente, montou-se o sistema (Figura 1). Acoplou-se uma rolha ao tubo de ensaio, para que pudesse vedar o sistema com maior eficiência. Depois, colocou- se a rolha com o tubo de ensaio no Kitassato, como mostra a figura 1.Essas rolhas continham um pequeno furo no topo para que permitissem acoplar os materiais medidores de pressão e temperatura, porém de tamanho suficiente para que não houvesse perdas do gás obtido para ambiente externo. Com esse sistema inicial montado, conectou-se a bomba a vácuo, afim de retirar o ar presente no Kitassato. Logo após a montagem do sistema, transferiu-se 5 mL de uma solução de HCl 1,0 M para o tubo de ensaio acoplado ao Kitassato. Em seguida, pesou-se 0,100 g de magnésio em aparas e logo após, colocou-se o metal dentro do tubo de ensaio contendo a solução ácida e vedou-se, primeiramente com a rolha que continha o termômetro e depois com a rolha acoplada ao manômetro, tudo muito rapidamente, para evitar perda do gás.
Resultado e discussão
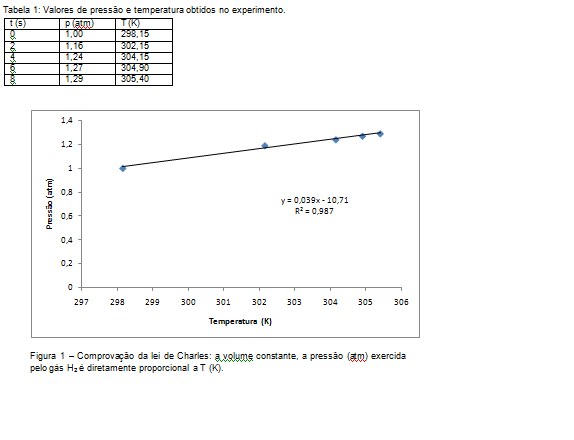
O tempo de reação entre o magnésio e o ácido clorídrico é muito rápido e a reação
é instantânea; os íons cloreto dissolvidos em água reagem rapidamente com o metal
magnésio, produzindo cloreto de magnésio, em solução. A um volume constante, os
valores da pressão e temperatura aumentam rapidamente em um curto espaço de tempo,
com a produção de gás hidrogênio (Tabela 1). Com a construção do gráfico (Figura
2), podemos observar a proporcionalidade nos aumento dos valores de pressão e
temperatura, confirmando a 2° lei de Charles, p1/p2=T1/T2, sendo ratificado pelo
valor apresentado no coeficiente de correlação dos dados.
Conclusões
Diante do experimento realizado, podemos comprovar a reatividade dos metais observando a formação do gás hidrogênio em laboratório, sendo possível medir quantitativamente a pressão e temperatura do sistema, assim sendo possível comprovar a lei de Charles para os gases ideais.
Agradecimentos
À Universidade Estadual do Maranhão (UEMA) e ao Laboratório de Química e Biologia (LQB).
Referências
ATKINS, P., JONES. L, Princípios de Química – Questionando a vida moderna e o meio ambiente - Porto Alegre: Bookman, 2001.
CRUZ, F. E. “Produção de hidrogênio em refinarias de petróleo: Avaliação exergética e custos de produção”. Dissertação de Mestrado apresentada à Escola Politécnica da Universidade de São Paulo. São Paulo, 2010.
ERICEIRA, E. R. Criação de protótipo para avaliação da obtenção do gás hidrogênio (H2), a partir da reatividade dos metais: Mg, Zn e Al com ácido clorídrico. Monografia (graduação)- Curso de Química Licenciatura, Universidade Estadual do Maranhão, 2012.










