ISBN 978-85-85905-10-1
Área
Físico-Química
Autores
Silva, R.C. (UNIVERSIDADE DO ESTADO DO AMAPÁ - UEAP) ; Ferreira, I.M. (UNIVERSIDADE DE SÃO PAULO - USP) ; Santos, C.F. (UNIVERSIDADE FEDERAL DO AMAPÁ - UNIFAP) ; Lobato, C.C. (UNIVERSIDADE FEDERAL DO AMAPÁ - UNIFAP) ; Braga, F.S. (UNIVERSIDADE FEDERAL DO AMAPÁ - UNIFAP) ; Costa, J.S. (UNIVERSIDADE FEDERAL DO AMAPÁ - UNIFAP) ; Ferreira, A.M. (UNIFAP) ; Silva, C.H.T.P. (UNIVERSIDADE DE SÃO PAULO - USP) ; Hage-melim, L.I.S. (UNIVERSIDADE FEDERAL DO AMAPÁ - UNIFAP) ; Santos, C.B.R. (UNIVERSIDADE FEDERAL DO AMAPÁ - UNIFAP)
Resumo
A química computacional vem conquistando espaço entre as técnicas que investigam fenômenos químicos. Os métodos que usam as energias do orbital molecular mais baixo desocupado (LUMO) e do orbital molecular mais alto ocupado (HOMO) têm sido usados nos cálculos de diversos parâmetros como: índice de reatividade química, afinidade eletrônica e potencial de ionização. O uso de microrganismos pode ser um método muito eficiente para produção de Dihidrochalconas. Este trabalho teve como objetivo estudar a reatividade e estabilidade de compostos derivados das Chalconas através da análise dos orbitais HOMO e LUMO. O produto mais estável dentre os investigados foi o composto 06, onde a variação entre o mais e o menos estável foi de -0.045 e -0.01019eV.
Palavras chaves
Derivados de Chalconas; Química computacional; orbitais de Fronteira
Introdução
Vários tipos de Chalconas e dihidrochalconas têm atraído atenção por serem relatadas como detentoras de atividades biológicas, sendo citotóxica (R. Anto et al 1995; S. Ducki 1998), antileishimanial (P. Boeck et al 2006), antibacterial (A. Joshi 2001 ), antitumoral (M. Cabrera 2007), anti-Trypanosoma cruzi (J. Aponte et al 2008), e antioxidante (J. Dong 2012). Tendo tal variedade de atividades farmacológica, estes compostos de interesse medicinal têm sido desenvolvidos. As chalconas apresentam dois anéis aromáticos ligados por três carbonos, uma carbonila e dois carbonos α-, β-insaturados. A classificação primária considera o número de substituintes no primeiro núcleo, que podem ser um, dois ou três. As chalconas de origem vegetal são sempre substituídas e, entre as mais comuns, localizadas no núcleo aromático, estão hidroxilas, metoxilas, O-glicosilas, C-glicosilas e C-alquilas, como propôs (ZUANAZZI, 2000) e (SORGATO 2007). O uso de modelagem molecular (MM) é um dos avanços mais importantes no desenho e na descoberta de novas drogas. Bentes et al (2011) usaram os cálculos de mecânica quântica no nível de teoria B3LYP/6-31G* no emprego para obtenção de energia (E), potencial de ionização (PI), entalpia de dissociação de ligação (O-H BDE) e energia de estabilização (ΔEiso) calcularam a atividade de eliminação de dihidrochalconas (DHC) e compostos relacionados estruturalmente. A estabilidade relativa para a forma do radical depende das posições específicas, como grupos hidroxila na posição Orto e Para ou um radical acetil na posição orto- e contribui para o efeito de ressonância. No trabalho realizou-se um estudo teórico usando o método DFT/6-31G* afim de investigar a reatividade química, estabilidade molecular e identificação de prováveis sítios de atividade biológica.
Material e métodos
Inicialmente foram selecionados 08 compostos da literatura (Ferreira et al 2014) a estrutura da chalcona foi calculada com o software Gauss View 3.0 (GaussView 3.0, 1997) usando o conjunto de bases B3LYP/6-31G* empregado com o programa Gaussian 03 (M. J. Frisch et al2004) com o método de teoria da densidade funcional (DFT). Após a otimização dos compostos estudados foram calculados descritores de reatividade global tais como: energia total (ET), eletronegatividade Mulliken (χ), Moleza molecular (η), Dureza molecular (1/η), potencial químico (), índice de eletrofílicidade global () energia do maior orbital molecular ocupado (HOMO), um nível inferior ao de energia do maior orbital molecular ocupado (HOMO-1), energia do menor orbital molecular desocupado (LUMO), um nível acima da energia do menor orbital molecular desocupado (LUMO+1) e GAP (HOMO-LUMO) que é um importante indicador de estabilidade e reatividade química, de acordo com Santos et al. As cargas atômicas utilizadas neste estudo foram obtidas com a palavra chave POP=CHELPG usando o potencial eletrostático (Breneman e Winberg 1990). Com esta estratégia foi possível obter o melhor potencial quântico molecular, uma serie de pontos em volta da molécula e as cargas atômicas oferecem a vantagem de ser fisicamente mais satisfatória do que as cargas Mulliken (Singh e Kollman 1984). Os orbitais de fronteiras (HOMO e LUMO) para as Chalconas e Dihidrochalconas foram obtidos a partir da carga atômica no nível de teoria B3LYP/6-31G*, usando o programa gaussian 03 e a visualização HOMO e LUMO foram construídos com a utilização do software Molekel (Molekel 4.3, 2000).
Resultado e discussão
Na Tabela 1 são mostrados os resultados dos cálculos de EHOMO, EHOMO-1, ELUMO,
ELUMO+1 e energia de GAP para chalconas (1-4) e dihidrochalconas (5-8) com o
B3LYP/6-31G*. Os valores de HOMO, ver Fig 1, variaram em escala crescente de
-0.01484 a -0.00085eV para os compostos 08 e 02, respectivamente. Os valores de
LUMO variaram de 0.0019 a 0.04174eV para os compostos 08 e 02, respectivamente.
Segundo Santos et al (2014) os orbitais moleculares HOMO e LUMO são descritores
de reatividade global que exercem importante papel nas reações químicas e na
formação de inúmeros complexos de transferência de cargas. Assim à medida que a
energia do HOMO aumenta, maior é a capacidade de doar elétrons, fato observado
no composto 02, e quanto menor a energia do LUMO menor será o impedimento para
aceitar elétrons como verificado no composto 08. Ainda na Tabela 1 verificou-se
que os valores de GAP variaram entre -0.045 e -0.01019eV. Assim, o composto 06
por ter maior valor de GAP pode possuir alta estabilidade molecular e baixa
reatividade química. O aumento do valor de HOMO pode estar ligado ao acréscimo
da atividade devido o aumento do potencial das regiões que podem realizar
ataques nucleofílicos, com isso, provavelmente, aumentando a afinidade por seus
alvos como propôs GRANT (1996). Moléculas que apresentam menores valores de GAP
são altamente reativas, enquanto moléculas que possuem alto valor de GAP indicam
alta estabilidade molecular, no sentido de baixa reatividade nas reações
químicas, segundo afirmou ZHANG (2007).
Ao analisar o HOMO, Fig 1, os glóbulos estão distribuídos na região do anel
benzênico X próximo ao grupo carbonílico, o que facilitaria os ataques
nucleofílicos com quantidade mínima de energia necessária para reagir com os
elétrons nesta região do anel.
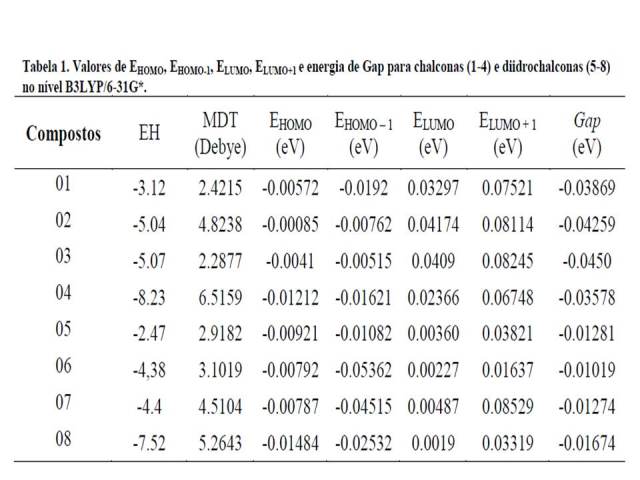
Na Tabela 1 são mostrados os resultados dos cálculos de EHOMO, EHOMO-1, ELUMO, ELUMO+1 e energia de GAP para chalconas (1-4) e dihidrochalconas (5-8).
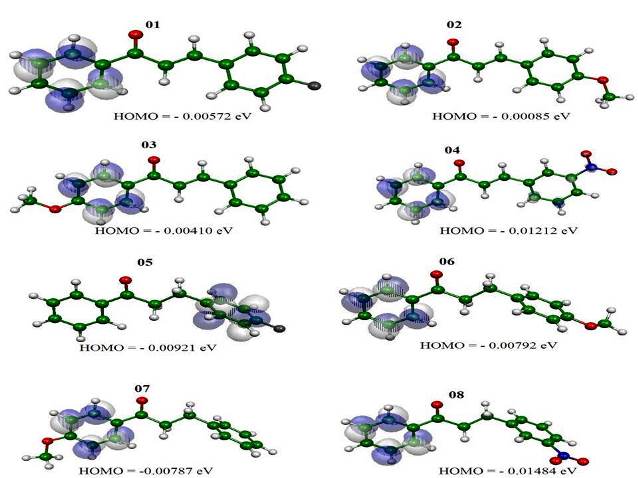
Figura 1, mapa de densidade eletrônica dos compostos estudados e valores de HOMO.
Conclusões
Neste estudo foram apresentados conceitos de orbitais de fronteira pelo uso da química computacional, que possibilita o aprofundamento da teoria através de cálculos químico-quânticos. Após calcular as energias dos orbitais de fronteira para os compostos, calculou-se os GAP a fim de obter a molécula mais estável. O composto mais estável foi o (composto 06), quando comparados com os valores de GAP dos demais compostos analisados. O mapa de densidade eletrônica mostrou a estrutura dos orbitais HOMO dos compostos analisados bem como os possíveis sítios de ataque.
Agradecimentos
Universidade Federal do Amapá–UNIFAP, Ao Laboratório de modelagem e Química computacional pela Infraestrutura e Universidade do Estado do Amapá–UEAP.
Referências
A. Bentes, R. Borges, W. Monteiro, L. de Macedo and C. Alves, Molecules, 2011, 16, 1749.
A. Joshi, X. Li, A. Nimrod, H. ElSohly, L. Walker and A. Clark, Planta Medica, 2001, 67, 186.R. Anto, K. Sukumaran, G. Kuttan, M. Rao, V. Subbubbaraju and R. Kuttan, Cancer Letters, 1995, 97, 33.
Breneman, C.M.; Winberg, K.B. Determining atom-centered monopoles from molecular electrostatic potentials. The need for high sampling density in formamide conformational analysis. J. Comput. Chem. 1990, 11, 361–373.
FERREIRA, I. M. ; ROCHA, L. C. ; Yoshioka,Sergio A. ; NITSCHKE, M. ; JELLER, A. H. ; PIZZUTI, L. ; PORTO, A. L. M.; Chemoselective reduction of chalcones by whole hyphae of marine fungus Penicillium citrinum CBMAI 1186, free and immobilized on biopolymers. Biocatalysis and Agricultural Biotechnology, v. 4, p. 66, 2014.
GaussView 3.07, Gaussian, Inc.; Pittsburgh, PA, 1997.
GRANT, G. H.; RICHARDS, W. G. Computational Chemistry. Oxford Science publications. 1996.
J. Aponte, M. Verastegui, E. Malaga, M. Zimic, M. Quiliano, A. Vaisberg, R. Gilman and G. Hammond, Journal of Medicinal Chemistry, 2008, 51, 6230.
J. Dong, M. Zhang, L. Lu, L. Sun and M. Xu, Food Chemistry, 2012, 135, 1220.
M. Cabrera, M. Simoens, G. Falchi, M. L. Lavaggi, O. E. Piro, E. E. Castellano, A. Vidal, A. Azqueta, A. Monge, A. L. de Ceráin, G. Sagrera, G. Seoane, H. Cerecetto and M. González, Bioorg Med Chem, 2007, 15, 3356.
M. J. Frisch, G. W. Trucks, H. B. Schlegel, G. E. Scuseria, M. A. Robb, J. R. Cheeseman, J. A. Montgomery Jr., T. Vreven, K. N. Kudin, J. C. Burant, J. M. Millam, S. S. Iyengar, J. Tomasi, V. Barone, B. Mennucci, M. Cossi, G. Scalmani, N. Rega, G. A. Petersson, H. Nakatsuji, M. Hada, M. Ehara, K. Toyota, R. Fukuda, J. Hasegawa, M. Ishida, T. Nakajima, Y. Honda, O. Kitao, H. Nakai, M. Klene, X. Li, J. E. Knox, H. P. Hratchian, J. B. Cross, C. Adamo, J. Jaramillo, R. Gomperts, R. E. Stratmann, O. Yazyev, A. J. Austin, R. Cammi, C. Pomelli, J. W. Ochterski, P. Y. Ayala, K. Morokuma, G. A. Voth, P. Salva- dor, J. J. Dannenberg, V. G. Zakrzewski, S. Dapprich, A. D. Daniels, M. C. Strain, O. Farkas, D. K. Malick, A. D. Rabuck, K. Raghavachari, J. B. Foresman, J. V. Ortiz, Q. Cui, A. G. Baboul, S. Clifford, J. Cioslowski, B. B. Ste-fanov, G. Liu, A. Liashenko, P. Piskorz, I. Komaromi, R. L. Martin, D. J. Fox, T. Keith, M. A. Al-Laham, C. Y. Peng, A. Nanayakkara, M. Challacombe, P. M. W. Gill, B. Johnson, W. Chen, M. W. Wong, C. Gonzalez and J. A. Pople, “Gaussian 03”, Revision C.02; Gaussian, Inc., Wallingford, 2004.
Molekel 4.3. Swiss Center for Scientific Computing: Manno, Switzerland, 2000.
P. Boeck, C. Falcao, P. Leal, R. Yunes, V. Cechinel, E. Torres-Santos and B. Rossi-Bergmann, Bioorganic & Medicinal Chemistry, 2006, 14, 1538.
Santos, C. B. R. S; Lobato, C. C; Sousa, M. A. C; Macêdo, W. J. C; Carvalho, J. C. T. Molecular Modeling: origin, fundamental concepts and applications using Struture-Activity Relationship and Quantitative Struture-Activity Relationship. Reviews in Theoretical Science, Vol. 2, No 2, pp. 91–115, 2014. 2014.
S. Ducki, R. Forrest, J. Hadfield, A. Kendall, N. Lawrence, A. McGown and D. Rennison, Bioorganic & Medicinal Chemistry Letters, 1998, 8, 1051.
Singh, U.C.; Kollman P.A. An approach to computing electrostatic charges for molecules. J. Comput. Chem. 1984, 5, 129–145.
SORGATO, S.; Atividade Antileucêmica de Chalconas Sintéticas. Programa de Pósgraduação em Farmácia da Universidade Federal de Santa Catarina.
ZHANG, G.; MUSGRAVE, C. B.; Comparison of DFT Methods for Molecular Orbital Eigenvalue Calculations, J Phys. Chem. A. 111, 1554-1561. 2007.
ZUANAZZI, J. A. S. Flavonóides. In: SIMÕES, C. M. O.; et al. (orgs).
Farmacognosia: da planta ao medicamento. 3 ed. Florianópolis: Editora Editora
da UFSC, Porto Alegre: Editora da UFRGS, 2000. Cap 23. p. 489-516.










