ISBN 978-85-85905-10-1
Área
Físico-Química
Autores
Andrade, R.B. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Costa, J.M. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Silva, G.N. (UNIVERSIDADE FEDERAL DA PARAÍBA)
Resumo
As energias relativas entre os reagentes, produtos e estados de transição envolvendo a reações decomposição de hidroperóxido foram avaliados com o método o funcional M062X e MP2 ambos com as bases: 6-311+g(d,p) e cc-pVDZ, Para investigar o efeito do íon cianeto no mecanismo de eliminação de hidroperóxido alquílico. A proposta é substituir o nucleófilo e avaliar a mudança na energia de barreira, com relação à troca do íon floreto.
Palavras chaves
Hidroperóxido; Mecanismo de Reação; Energia de Barreira
Introdução
Um peróxido contém o grupo funcional peróxido ROOR', para R' sendo um átomo de hidrogênio, o composto é denominado de hidroperóxido orgânico. A ligação O−O se rompe facilmente podendo formar radicais livres da forma RO• fazendo com que os peróxidos sejam muito úteis como iniciadores para alguns tipos de polimerizações. O peróxido de metiletil cetona (C4H10O4) e peróxido de benzoíla (C14H10O4), ainda sobre os peróxidos orgânicos, são altamente inflamáveis, materiais explosivos, frequentemente potentes e voláteis. Atualmente é atribuído ao hidroperóxido de alquila ROOH um papel essencial na oxidação bioquímica de lipídios durante stress oxidativo (desequilíbrio relacionado com a produção de espécies reativas de oxigênio em sistemas biológicos). Estes compostos químicos ROOH, onde os grupos R são ácidos graxos insaturados (ácidos monocarboxílicos de cadeia normal que apresentam o grupo carboxila –COOH ligado a uma longa cadeia alquílica), são vistos como intermediários que são facilmente degradados, devido a instabilidade da ligação RO−OH, para se obter aldeídos potencialmente genotóxicos e cetonas[1]. Geralmente, o decomposição de hidroperóxidos de alquila provavelmente é mediada por abstração de radical ou processos de transferência de elétrons geralmente envolvendo enzimas, metais de transição e até mesmo a vitamina C[2]. Algumas evidências apontam que a decomposição heterolítica de hidroperóxidos de alquilo O objetivo geral deste estudo é determinar a influência do nucleófilo cianeto na energia de barreira envolvendo o mecanismo de reação de eliminação de hidroperóxidos alquílicos.
Material e métodos
Para a investigação dos mecanismos de reações de decomposição de hidroperóxido utilizamos cálculos de otimização e frequência dos reagentes e prováveis produtos bem como a caracterização dos estados de transição envolvidos. Utilizando o software Gaussian09 empregando os métodos Teoria do Funcional da Densidade DFT com o funcional M062X e Teoria de Perturbação de Møller-Plesset de segunda ordem MP2, com as bases: 6-311+g(d,p) cc-pVDZ. Para investigar o efeito de nucleófilos mais fracos no mecanismo de eliminação de hidroperóxido alquilícos, a proposta foi substituir o nucleófilo e avaliar a mudança na energia de barreira, com relação à troca do íon floreto por cianeto.
Resultado e discussão
Na reação entre F- e CH3OOH3, ocorre principalmente a formação de HO- com
rendimento de 5% aproximadamente, enquanto que a transferência de prótons é cerca
de 10% (ver Figura 2). A formação de íons HO- na reação sugere um mecanismo de
eliminação (semelhante ao de uma reação de eliminação bimolecular) em fase gasosa
para a eliminação de NO, uma das “exigências” desse tipo de mecanismo é que a
estereoquímica dessas reações sempre ocorra através da geometria "periplanar", o
que significa que todos os quatro átomos reagentes,
nesse caso os dois oxigênios o átomo de carbono e o hidrogênio que sai junto do
floreto, estejam no mesmo plano.
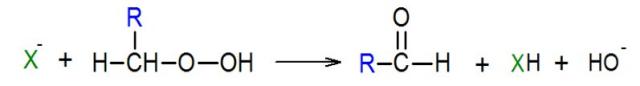
Equação química que representa a decomposição de um Hidroperóxido

Conclusões
O mecanismo de reação ECO2 com NC-, que é uma base significativamente mais fraca do que o F-, juntamente com o seu estado de transição foi calculado resultando numa energia de barreira de 8,5 kcal/mol enquanto que essa energia de barreira para a reação com floreto é de cerca de alguma kcal (Figura 2).
Agradecimentos
Ao Laboratório de Modelagem Molecular e Reações Químicas da UFPB e ao CNPq pela bolsa concedida.
Referências
[1]Murphy, R. C.; Fiedler J.; Hevko, J. Chem. ReV. 101, 479, 2001.
[2]Lee, S. H.; Oe, T.; Blair, I. A. Science, 292, 2083, 2001.
[3]King, G. K.; Maricq, M. M.; Bierbaum, V. M.; DePuy, C. H. J. Am. Chem. Soc. 103, 7133, 1981.










