ISBN 978-85-85905-10-1
Área
Química Analítica
Autores
de Almeida Morais, K. (UESPI) ; e Silva Alves, P. (UESPI) ; Ferreira de Castro, N. (UESPI) ; Karenina Bacelar Santana, P. (UESPI) ; Simone Cardoso, F. (UESPI) ; dos Santos Lima, M. (UESPI) ; Alves Cardoso, B. (UESPI) ; Gonzaga Sousa, H. (UESPI) ; de Sousa Cunha, F. (UESPI) ; Roberto de Oliveira Torres, J. (UESPI)
Resumo
Água Mineral é um recurso natural que não deve sofrer nenhum tipo de intervenção por parte da empresa, em se tratando de um recurso natural, a mesma está sujeita a variações de sua composição em função de condições climáticas e estações do ano, como por exemplo. Para que haja a comercialização de uma Água Mineral, o órgão responsável do Ministério de Minas e Energia, o DNPM (Departamento Nacional de Proteção Mineral), há 3 anos, realiza por intermédio do LAMIN (Laboratório de Análises Minerais) uma análise da composição química da água e sua classificação. O resultado dessa análise deve ser atualizado no rótulo do produto. Dessa forma, o presente trabalho tem como objetivo determinar a porcentagem (teor) de Cloreto na amostra de uma marca de água mineral comercializada na região em mg/L.
Palavras chaves
Água mineral; Titulação; método de Mohr
Introdução
O cloro, na forma de íon cloreto (Cl-), é um dos principais ânions inorgânicos em águas naturais e residuárias. Em água potável, o sabor produzido pelo íon Cl- varia em função da sua concentração, como também da composição química da água. Assim, águas contendo 250 mg Cl-/L podem ter um sabor salino detectável, se o cátion que propicia o equilíbrio iônico da solução for o sódio (Na+). Enquanto que, no caso do cátion predominante for cálcio ou magnésio, o gosto salino pode ser perceptível somente a concentração de cloreto acima de 1000 ppm. (BACCAN, 2001) Dessa maneira, o método de Mohr foi descrito pela primeira vez em 1865 por K.F. Mohr, um químico farmacêutico alemão, que foi um pioneiro no desenvolvimento da titulometria. Com a descoberta de que o Cr (VI) é carcinogênico, atualmente o método de Mohr é raramente empregado. A titulação de Mohr deve ser realizada em pH de 7 a 10 porque o íon cromato é a base conjugada do ácido crômico fraco. Consequentemente, em soluções mais ácidas, a concentração dos íons cromato é muito pequena para se produzir o precipitado nas proximidades do ponto de equivalência. Normalmente, um pH adequado é obtido saturando-se a solução do analito com hidrogênio carbonato de sódio. (SKOOG, 2002) Logo, o termo "análise de titulação" refere-se à análise química quantitativa levada por a determinação do volume de uma solução, de forma no qual precisa conhecer a concentração que é necessária para reagir quantitativamente com um volume medido de uma solução da substância a ser determinada. A solução no qual se conhece com precisão a força é chamada de solução padrão. (VOGEL, 1989)
Material e métodos
A pesquisa foi realizada em Abril de 2014, no Laboratório de Pesquisa da Universidade Estadual do Piauí. Partiu-se de uma solução de Nitrato de Prata na concentração de 0,02 mol/L. Mediu-se 50 mL de água mineral e adicionou-se 1 mL de solução indicadora de cromato de potássio a 5%. Colocou-se a solução padronizada de nitrato de prata numa bureta de 50 mL e procedeu-se à titulação até a mudança de coloração de branco para vermelho. Repetiu-se por mais duas vezes sendo uma desta com água destilada (teste branco).
Resultado e discussão
O método de Mohr foi utilizado na determinação de íons cloreto, este se baseia
na precipitação dos íons cloreto com Nitrato de Prata.
Utilizando os dados expressos na Tabela 1 foi calculado o volume gasto de AgNO3,
logo : Volume gasto = V1 + V2 /2 - Vbranco = 2,5 + 3,0 /2 – 0,3 = 2,45 mL.
Assim foi calculado também o teor de Cloreto presente na água mineral cuja
formula, Teor de Cloreto em ppm = V1 x 0,02 x 35,5 x 1000/V2 contudo, onde: V1
= Volume de solução de Nitrato de Prata gasto na titulação. V2 = Volume de
solução da amostra analisada. Concentração da solução de Nitrato de Prata = 0,02
mol/L, dessa forma, o teor de Cloreto em ppm = 2,45 x 0,02 x 35,5 x 1000/ 50 =
34,79 mg/L.
Com relação à concentração de cloreto da amostra de água analisada apresentou um
teor de cloreto de 34,79 mg/L acima das informações contidas nos rótulos de
17,09 mg/L,em geral, quantidades razoáveis de cloretos não são prejudiciais à
saúde, mas transmite a água uma leve alteração como um sabor levemente
salgado(salobro). Contudo segundo ministério da saúde, em sua Portaria n°. 36/6M
de 19.01.90, o teor máximo de cloreto permissível, em águas de abastecimento, é
de 250 mg/L , portanto estando dentro do valor máximo permitido.
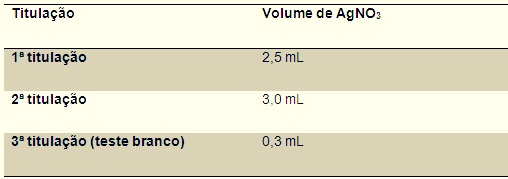
Mostra os valores obtidos das triplicadas.
Conclusões
De acordo com os resultados obtidos neste experimento, concluiu-se que o teor de cloreto presente na água mineral comercializada na região de 34,17 mg/L corrobora com a literatura, visto que o mesmo se encontra dentro dos padrões estabelecidos pelo Ministério da Saúde.
Agradecimentos
A DEUS, MÃE, AMIGOS E UESPI.
Referências
BACCAN, N. e outros. Química Analítica Quantitativa Elementar. São Paulo: Edgar Blucher Ltda., 2001. 167P.
BRASIL – Normas, Leis, Portarias: Portaria 36, Ministério da. Saúde. "Padrão de
Potabilidade da Água Destinada ao Consumo Humano, 19/11/90. Diário Oficial da União.
SKOOG, D.A; Et al, Fundamentos da Química Analítica. 6 th Ed., N. York: Ed. Saunders College, 2002. P341.
TORRES, J. R. O E TORRES, T.D. Experimentos em Química Analítica Quantitativa. V.1, Imperatriz; Ética, 2012.










