ISBN 978-85-85905-10-1
Área
Química Analítica
Autores
Medeiros, M.O.M. (UFRN) ; Araújo, K.C.F.A. (UFRN) ; Araújo, D.M.A. (UFRN) ; Varela, H.V. (IQSC/USP) ; Martínez-huítle, C.A.M. (UFRN)
Resumo
Este estudo teve por objetivo verificar a influência da temperatura na produção de persulfato, além de determinar o mecanismo pelo qual ele é formado, a partir de 9 adições de água, cada uma sendo de 2.10-3 L, em 6.10-3 L de ácido sulfúrico concentrado, por meio do método eletroanalítico de voltametria linear, utilizando como eletrodo de trabalho o diamante dopado com boro. As temperaturas testadas nos experimentos foram 313 K e 333 K, sendo a primeira mais eficaz na formação do peroxodissulfato, gerando um sinal indicativo de ocorrência de processo eletroquímico na proximidade entre 2,0 e 2,1 V, a partir do acréscimo de 6.10-3 L de água.
Palavras chaves
Temperatura; Produção de persulfato; Diamante dopado com boro
Introdução
Entre os vários oxidantes disponíveis, o persulfato tem se destacado nos últimos anos, por ser usado na remediação de solos e descontaminação de efluentes. Como os estudos em torno da diminuição dos níveis de poluição se intensificaram nos últimos tempos, tornou-se importante descobrir uma forma mais eficiente de produção do persulfato, visto que tem sido cada vez mais utilizado em processos de oxidação in situ. (LIU et al., 2012). Eletrodos de DDB têm atraído bastante interesse de pesquisadores devido às suas excelentes propriedades para eletroanálise e outras aplicações eletroquímicas. (EINAGA; FOORD; SWAIN, 2014). Isso se deve ao fato do eletrodo de diamante possuir uma superfície inerte, com baixa taxa de adsorção, notável estabilidade à corrosão – mesmo em meio ácido concentrado – e ampla janela de potencial em soluções aquosas. (PANIZZA; CERISOLA,2005). A oxidação de compostos na superfície do DDB pode ocorrer por dois mecanismos, a depender do potencial aplicado: oxidação direta na faixa de potencial antes do desprendimento de oxigênio; e, transferência eletrônica indireta a partir de radicais hidroxila eletrogerados, na região de desprendimento de oxigênio (TEIXEIRA, 2012). Dito isso, o ácido sulfúrico em solução aquosa pode formar persulfato via dois mecanismos. (KHAMIS et al,2010). São eles: 2SO42- → S2O82- + 2e- (1); 2HSO4- → S2O82- + 2H+ + 2e-(2) O objetivo desse trabalho foi avaliar o comportamento do ácido sulfúrico conc. frente ao ânodo de DDB, a medida que era adicionado água, a fim de comprovar a produção de persulfato e o seu mecanismo de formação. Os experimentos foram feitos em elevadas temperaturas, por ser um dos fatores que podem acelerar a formação de peroxodissulfato (LIU et al., 2012).
Material e métodos
Para este trabalho, os reagentes utilizados foram: • Água de osmose-reversa; • Ácido sulfúrico concentrado (98%). Fabricante: Quimex. A eletroanálise foi realizada no Potenciostato 302 N da AutoLab, o qual estava programado com os seguintes parâmetros: intervalo de potencial de -0,5 V a +2,7 V e taxa de varredura 50.10-3 V/s. Em seguida, a cela fora montada com o arranjo: contra-eletrodo de platina à esquerda, eletrodo de calomelano (referência) no meio e o eletrodo de trabalho DDB – cujas dimensões eram 1,2.10-4 m2 – à direita, os quais ficaram submersos em 6,0.10-3 L de ácido sulfúrico. Além disso, um termostato foi acoplado à célula eletroquímica, a fim de controlar a temperatura. As análises foram feitas a 313 K e 333 K (40ºC e 60ºC, respectivamente) e, para as duas temperaturas, os procedimentos foram os mesmos. Deste modo, a primeira varredura se deu somente com H¬2SO4 conc.. Finalizado o primeiro ciclo, foram acrescentados 2,0.10-3 L de água e, com o auxílio de um agitador magnético, misturou-se a solução por 30 s; em seguida, foi realizada uma nova leitura. Ao final, foram feitas 9 adições de água, resultando em 1,8.10-2 L.
Resultado e discussão
De acordo com a Fig.1 não existe sinal indicando a ocorrência de processos
eletroquímicos quando com o H2SO4 conc, porém com as adições de água a partir da
3ª adição começa a ser formado pico no potencial de 2,1 V. Esse sinal é
referente a produção de persulfato (presente na voltametria). Com isso, duas
hipóteses são sugeridas: a ocorrência de uma reação, já que necessitou de um
potencial e a segunda, leva-se em conta a produção eletroquímica de um estado de
superfície ativada correspondente a um par redox na superfície do eletrodo de
DDB, ou seja,
DDB + H2O → DDB(HO•) + H+ + e- (3)
No entanto, a segunda hipótese é altamente dependente da geração dos
intermediários DDB(HO•) e DDB(SO4-•); com isso, observando a reação (3),
percebe-se que quanto mais H2O, mais DDB(HO•) é formado e, consequentemente, há
maior produção de persulfato, devido ao aumento de espécies DDB(SO4-•)
disponíveis para reagir. Porém, ao observar a Figura 1, nota-se que os sinais
convergem para um determinado valor e, por isso, a taxa de formação de S2O82-
não aumenta com a adição de água; isso implica que o peroxodissulfato está sendo
obtido via mecanismo reacional (1).
Ao analisar a Figura 2, percebeu-se a formação de sinais a partir da terceira
adição, porém, diferentemente do que aconteceu a 313 K, o pico não foi em torno
2,1 V, o que significa que o processo de formação de espécies ocorreu através de
outro mecanismo. Este comportamento pode estar vinculado à degradação do
persulfato, que se deve a formação de H2O2. Assim, esse novo sinal observado em
1,7 V sugere a parcial formação de persulfatos, em baixas concentrações, que são
rapidamente degradados a H2O2.
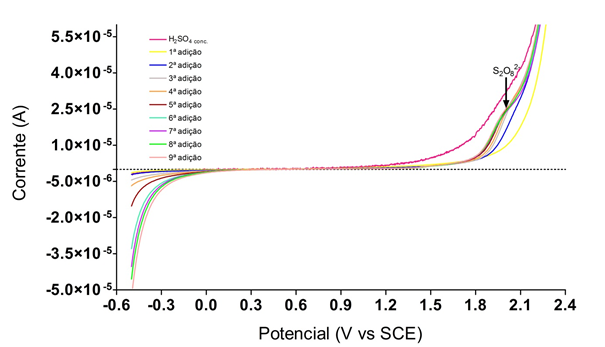
Curva de Varredura Linear para o estudo da influência da temperatura de 313 K na produção de S2O82-, a partir da adição de água em H2SO4 conc..
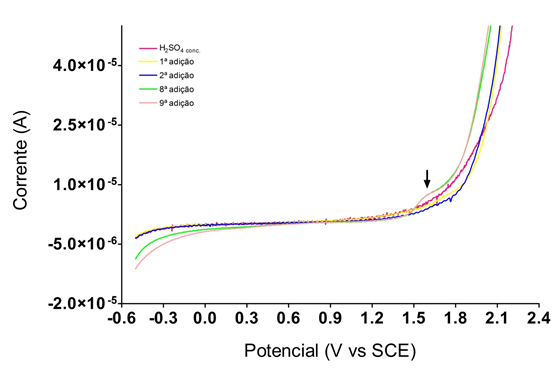
Curva de Varredura Linear para o estudo da inflência da temperatura de 333 K na produção de S2O82-, a partir da adição de água em H2SO4 conc.
Conclusões
Neste trabalho, foi analisado o comportamento do ácido sulfúrico concentrado, quando água era adicionada a ela, de modo a verificar, através da voltametria linear, a produção de persulfato em diferentes temperaturas. Com base no estudo desenvolvido, é possível destacar que a produção de persulfato é favorecida a 313 K e ocorre via mecanismo (1), o que significa dizer que a formação de peroxodissulfato é beneficiada na presença de altas concentrações de SO42-.
Agradecimentos
Agradeço a PROPESP-UFRN pela bolsa de iniciação científica concedida, possibilitando que tal estudo tenha sido realizado.
Referências
EINAGA, Yasuaki; FOORD, John S.; SWAIN, Greg M. Diamond electrodes: Diversity and maturity. MRS Bulletin, v. 39, p. 525-532, 2014.
KHAMIS, D. MAHÉ, E.; DARDOIZE, F.; DEVILLIERS, D. Peroxodisulfate generation on boron-doped diamond microelectrodes array and detection by scanning electrochemical microscopy. J Appl Electrochem, v. 40, p. 1829-1838, 2010.
LIU, C. S.; SHIH, K.; SUN, C. X.; WANG, F. Oxidative degradation of propachlor by ferrous and copper ion activated persulfate. Science of the Total Environment, v. 416, p. 507-512, 2012.
PANIZZA, M.; CERISOLA, G. Application of diamond electrodes to electrochemical processes. Electrochimica Acta, v. 51, p. 191-199, 2005.
TEIXEIRA, M. E. Aplicação do eletrodo de diamante dopado com boro modificado pelo método Sol-Gel para determinação e degradação de carbaril. 2012. Tese (Doutorado) – Instituto de Química de São Carlos, Universidade de São Paulo.










