ISBN 978-85-85905-10-1
Área
Química Analítica
Autores
Fonseca Silva, E. (UNIVERSIDADE FEDERAL DO MARANHÃO - UFMA) ; Nunes Fernandes, R. (UNIVERSIDADE FEDERAL DO MARANHÃO UFMA) ; Souza de Lima, H. (UNIVERSIDADE FEDERAL DO MARANHÃO UFMA) ; Roberto Barros Gomes, P. (UNIVERSIDADE FEDERAL DO MARANHÃO UFMA) ; Souza de Lima, W. (UNIVERSIDADE FEDERAL DO MARANHÃO UFMA)
Resumo
Este trabalho descreve a utilização da reação de Trinder para a determinação de ácido acetilsalicílico em fármacos. O método se baseia na reação entre os íons salicilatos, com os íons Fe3+, resulta na formação de um complexo de coloração violeta [Salicilato-FeIII] monitorado espectrofotometricamente com máximo de absorção em torno de 525nm. Para verificar o comprimento de onda de máxima absorção do complexo colorido (Salicilato-FeIII), utilizou-se um espectrofotômetro com duplo cromador. Para determinação do teor de AAS em fármacos, a medidas foram realizadas num espectrofotômetro. Os resultados obtidos mostram que o sistema analítico proposto é satisfatório para a determinação quantitativa de AAS em uma faixa de concentração de 25 mg/L a 100 mg/L (R=0,999) de ácido acetilsalicílico.
Palavras chaves
Ácido acetilsalicílico; Reação de Trinder; Espectrofometria
Introdução
O ácido acetilsalicílico, também conhecido como AAS ou Aspirina, foi a primeira droga sintética a ser comercializada. Esse fármaco é um medicamento comum encontrado com facilidade em todas as farmácias do mundo. É indicado como analgésico, antipirético e anti-inflamatório no tratamento de febres reumáticas, crises de gota e artrites reumáticas. A determinação do ácido acetilsalicílico em preparações farmacêuticas é importante para a avaliação da sua qualidade. Uma vez que o uso constante do AAS também pode gerar problemas de saúde, principalmente na indução de lesões gástricas, úlceras e hemorragias, assim como acidentes de intoxicação com crianças, devido à acessibilidade desta droga. A maioria dos métodos se mostra pouco prático, visto que necessitam de etapas de pré-tratamento e extração da amostra, aumentando assim o custo do processo e demandam uma grande quantidade de tempo, além de empregarem solventes orgânicos de média ou alta toxicidade. Neste contexto, o trabalho aqui proposto tem como principal meta determinar o ácido acetilsalicílico em fármacos através da reação de Trinder. Esta estratégia se justifica por tratar-se de um método analítico que se encontra em concordância com as tendências atuais no que tange aspectos econômicos e analíticos, além de menor impacto ambiental, pelo baixo consumo de amostras e reagentes, baixas gerações de resíduos e simples operação.
Material e métodos
Todos os reagentes utilizados foram de grau analítico de pureza e todas as soluções foram preparadas com água deionizada. A vidraria laboratorial utilizada foi previamente mantida por um período de 24h sob uma solução a 10% (v/v) de ácido nítrico. Após esse período a vidraria foi lavada com água destilada e com água deionizada para as análises.A solução estoque de NaOH (IMPEX) 1,0 mol.L-1 foi preparada dissolvendo 4,0g dessa base em 100mL de água deionizada. A solução de Fe+3 (reagente Trinder) foi preparada dissolvendo 1,0g de nitrato férrico [Fe (NO3)3 9H2O] (ISOFAR) em um balão volumétrico de 100 mL e completando o volume com água deionizada. A solução estoque de ácido acetilsalicílico (SYNTH) 1,0g.L-1 foi preparada dissolvendo 0,25g desse ácido em 10 mL de solução NaOH 1,0mol. L-1, promovendo o aquecimento por 10min em chapa de aquecimento, para obter uma completa hidrólise do AAS. Em seguida transferindo o conteúdo para um balão de 250 mL e aferindo-se com água deionizada. A partir dessa solução, com diluições adequadas, foram preparadas as demais soluções de AAS empregadas neste trabalho. Três diferentes formulações contendo 80, 100 e 500mg de ácido acetilsalicílico, descrita pelo fabricante, foram analisadas. Para cada amostra foram tomados 20 comprimidos, que foram pesados e pulverizados. Uma quantidade adequada de cada amostra foi dissolvida em 10 mL de NaOH 1,0mol.L-1 promovendo o aquecimento por 10min em chapa de aquecimento, para uma melhor hidrólise do AAS. Eventuais excipientes insolúveis contidos nas amostras foram removidos por filtração simples. Em seguida transferindo o conteúdo para um balão de 100 mL e aferindo-se com água deionizada.
Resultado e discussão
Para a definição do melhor comprimento de onda e discriminação do sinal
analítico do método proposto, fez-se o estudo espectrofotométrico do complexo
Fe(Sal)33+ como mostra a Figura 1. Com base no espectro eletrônico obtido,
percebeu-se que o complexo de interesse apresentou boa absortividade molar e
resolução analítica, ou seja, aproximadamente 0,8u.a, na faixa de 450 a 650 nm,
com comprimento de onda máximo em 525 nm. Curva analítica do método: Após
determinação do comprimento de onda do máximo de absorção do Salicilato de ferro
III (525nm), as características analíticas foram estimadas. Na Figura 2 é
mostrada uma curva analítica obtida em triplicata, descrita pela equação: Y =
0,0115 + 0,00797X. O coeficiente de correlação R= 0,999 indica uma ótima
resposta linear entre 25 a 100 mg.L-1 de AAS, portanto, o procedimento proposto
obedece a Lei de Beer nesta faixa de concentração. Análise de Formulações
Farmacêuticas: Após as análises das soluções padrões e obtenção da curva
analítica, a metodologia foi aplicada à determinação de AAS em formulações
farmacêuticas e os resultados foram comparados com os rotulados pelos
fabricantes.Três amostras de formulações farmacêuticas, designadas A1, A2,
A3, foram analisadas. A amostra designada (A3), foi analisada após diluição
manual de 10 vezes. De acordo com os resultados, observa-se que, empregando-se a
reação de Trinder estão em concordância com os resultados rotulados pelo
fabricante. Teste De Recuperação: O teste de recuperação foi realizado com o
objetivo de obter informações sobre possíveis interferências geradas pela matriz
dessas amostras sobre a resposta obtida. Para este estudo foram feitos
experimentos em triplicata, por meio da adição de alíquotas de soluções padrão
de AAS às soluções contendo amostras.
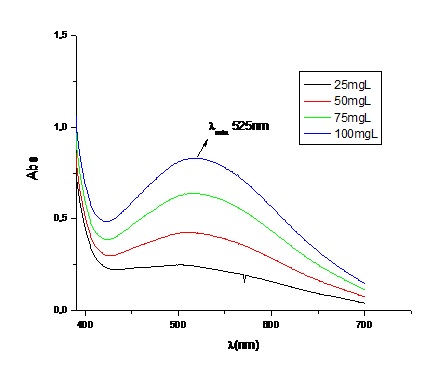
Espectro eletrônico do complexo Fe(Sal)3+3 (λmax.=525 nm) na faixa de concentração de 25 a 100 mg.L-1
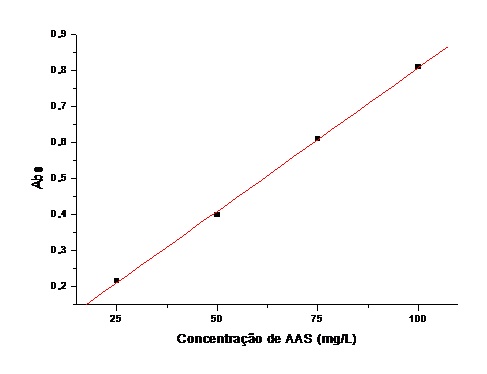
Curva analítica para determinação de AAS em comprimidos utilizando a reação de Trinder.
Conclusões
Os valores das analises das amostras farmacêuticas contendo o AAS, foram concordantes com os valores rotulados pelo fabricante. Os resultados obtidos com teste de recuperação variaram entre 99,6 e 104%, não apresentando interferência significativa da matriz das amostras na determinação do AAS pela reação de Trinder. Assim de acordo com esses resultados, a metodologia aplicada neste trabalho demonstra ser viável para aplicação de amostras contendo AAS, sobretudo em análises de rotinas.
Agradecimentos
UFMA e aos demais colaboradores
Referências
SHRIVER, D. A.; DOVE, P. A.; WHITE, C. B.; SANDOR, A.; ROSENTHALE, M. E.; Toxicol. Appl. Pharmacol. 1977,42,75.
SARTORI, E. J. R. Determinação voltamétrica de analitos de interesse farmacêutico utilizando um eletrodo de diamante dopado com boro Tese (Doutorado em Ciências)-Universidade Federal de São Carlos, São Carlos, 2009.
RODRIGUES, C. T.; TUBINO, M.; ELSHOLZ, O.; SILVA, J. R. F.; LIMA, E. T.; MOREIRA, P. M. G. Medidas do medicamento Ácido Acetil Salicílico (AAS) com Fotômetro de baixo custo. Revista Intercursos, 7: 88, 2008.
Brasil. Farmacopeia Brasileira, volume 2 / Agência Nacional de Vigilância Sanitária. Brasília: Anvisa, 2010.904p.










