ISBN 978-85-85905-10-1
Área
Ambiental
Autores
Brito, C.N. (UFRN) ; Moura, D.C. (UFRN) ; Martínez-huitle, C.A. (UFRN)
Resumo
Este trabalho relata os resultados experimentais e conclusões relacionadas à evolução temporal das concentrações das espécies cloradas, a fim de associar sua formação e consumo através de reações químicas ou eletroquímicas. Este estudo foi realizado utilizando dois eletrodos, o Ti/Ru0.3Ti0.7O2 e o BDD, adicionando uma concentração conhecida de NaCl 5g/L em solução aquosa, variando apenas a aplicação de diferentes densidades de corrente 25, 50 e 75 mA.cm-2. Os resultados demonstraram que espécies de cloro ativo (Cl2, ClO2, ClO2- e ClO3-) foram formadas eletroquimicamente. As tendências de concentração de Cl2 dissolvido e ClO2- indicaram que a via eletroquímica foi responsável pela sua presença na solução, e estas espécies ativas são responsáveis pela formação de outras espécies de cloro.
Palavras chaves
espécies cloradas; cloro ativo; via eletroquímica
Introdução
A produção de espécies cloradas no tratamento eletroquímico auxilia na degradação da matéria orgânica por abordagens diretas ou indiretas na eliminação de poluentes diretamente na superfície do ânodo, via produção de •OH (SIRÉS et al, 2014) diretamente no local usando apenas água, sal e energia. O interessante dessa oxidação, é a presença de íons cloreto que possibilita o envolvimento do mesmo durante o tratamento eletroquímico; e a química e eletroquímica dos estados de oxidação mais elevados para cloro perto de pH neutro (PANIZZA e CERISOLA, 2009, MARTINEZ-HUITLE e BRILLAS, 2008). Um dos eletrodos anódicos estudados é o de Diamante Dopado com Boro (BDD) por produzir grandes quantidades de reagentes reativos (•OH) e mineralizar poluentes aromáticos e ácidos carboxílicos gerados. Quando a solução contém íons cloreto, o processo de oxidação avançada é mais complexa porque as espécies de cloro ativo, como Cl2, HClO, e/ou ClO- produzidos a partir da oxidação do Cl- nos anodos, competem com radicais M(•OH) para atacar compostos orgânicos. É importante notar que, nenhum trabalho tem indicado a produção de espécies ativas de cloro utilizando BDD até o momento (SALAZAR, 2013). Desse modo, o trabalho apresentado tem seu potencial inovador na área da eletroquímica. Outro ânodo analisado foi o RuO2 conhecido por sua atividade eletrocatalítica de oxigênio e evolução de cloro (NEODO et al, 2013). A fim de avaliar as características que cada eletrodo apresenta no processo eletroquímico, o presente trabalho tem por objetivo caracterizar, testar e aplicar métodos de eletroxidação para analisar a evolução de espécies cloradas em diferentes variáveis experimentais, como densidade de corrente, pH e a concentração das espécies de cloro ativo.
Material e métodos
O estudo eletroquímico foi realizado através de experimentos em batelada em uma célula eletroquímica com capacidade de 0,5L contendo NaCl com concentração igual a 5g/L. O processo foi realizado a temperatura ambiente de 25ºC, sob agitação, aplicando distintas densidades de corrente (25, 50 e 75 mA.cm-2) através da fonte de alimentação MINIPA MPL–3305. O eletrodo catódico foi o de titânio e os anódicos foram Ti/Ru0.3Ti0.7O2 e BBD que possuem área geométrica de aproximadamente 50 e 10 cm2, respectivamente. O eletrodo de Ti/Ru0.3Ti0.7O2 foi fornecido pela De Nora S.p.A (São Paulo, Brasil), como parte de um acordo de colaboração cientifica e parcerias internacionais. Para determinar a concentração de espécies de cloro ativo produzido (Cl2, ClO2, ClO2- e ClO3-) foram realizadas uma sequência de titulações iodométricas, em que alíquotas de 5 ml foram analisadas quimicamente. (ROSESTOLATO, 2008) A duração do estudo eletroquímico foi de 120 minutos com monitoramento temporal do pH e do potencial. As espécies de cloro ativo foram empregadas em uma solução de efluente real para monitorar a carga orgânica, onde foi utilizado o analisador de Carbono Orgânico total (COT) Analytik Jena Multi N/C 3100.
Resultado e discussão
Nas mesmas condições de densidades de correntes e concentração do sal (NaCl) em
solução, analisou-se a evolução das concentrações de espécies cloradas
produzidas a partir da utilização de diferentes eletrodos anódicos. No eletrodo
de Ti/Ru0.3Ti0.7O2 podemos notar nos gráficos da Figura 1, que a produção das
espécies Cl2 e ClO2- é mais evidente que a de ClO2 e ClO3- quando aplicadas as
densidades de 25 a 75 mA.cm-2. Este comportamento pode ser correlacionado com a
observação sobre a instabilidade do dióxido de cloro em meio alcalino (NEODO et
al, 2013). A 50 mA cm-2, o clorito é a espécie predominante ativa quando se
equipara com 25 mA cm-2, onde o Cl2 é preferencialmente produzido. Como afirmado
por Neodo et al., o mecanismo de redução do clorito ocorre com o estabelecimento
de interações de adsorção entre os eletrodos e as espécies. Os resultados para o
eletrodo de BDD distinguem do eletrodo de Ti/Ru0.3Ti0.7O2 quando se refere à
produção de Cl2 e ClO2-, onde no eletrodo de Ti/Ru0.3Ti0.7O2 é nitidamente
visível que na menor densidade de corrente a espécie com maior concentração é ao
Cl2 e que ao aumentar a densidade essa espécie reduz sua concentração. Na Figura
1, nos gráfico do BDD a concentração Cl¬2 se mantem, praticamente constante e a
de ClO2 aumenta a medida que aumentamos a densidade de corrente mediante os
mecanismos de equilíbrio do sistema HClO/ClO− que acontecem exclusivamente na
proximidade do anodo. A Figura 2 apresenta a remoção da carga orgânica pela
análise de COT utilizando o eletrodo de Ti/Ru0.3Ti0.7O2 que de acordo com o
gráfico podemos observa que após 10 min de eletrólise o percentual de remoção
chegou a 80% utilizando os valores mínimos e máximos de densidade de corrente.
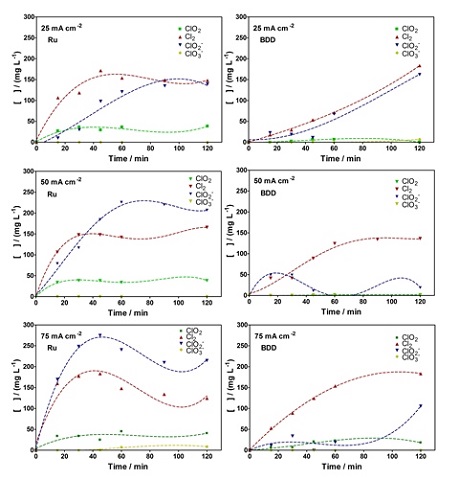
Comportamento da evolução das espécies de cloro ativo nos eletrodos de Ti/Ru0.3Ti0.7O2 e BDD, em diferentes densidades de corrente, em solução de NaCl 5g/l, 25ºC, no tempo de 120 min.
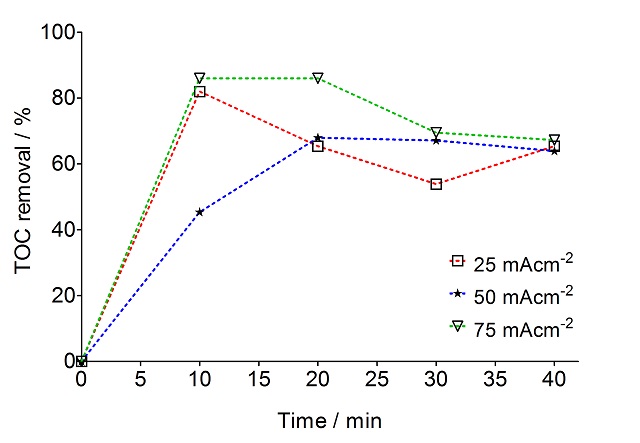
Perfil de remoção de TOC, como uma função de tempo, a diferentes densidades de corrente: 25; 50 e 75 mA cm-2, utilizando o eletrodo de Ti/Ru0.3Ti0.7O2.
Conclusões
As análises realizadas nos eletrodos estudados mostraram que no processo de eletrólise os materiais eletrocatalíticos usados produziram espécies oxidantes de cloro ativo. Para o eletrodo de BDD e Ti/Ru0.3Ti0.7O2 as espécies Cl2 e ClO2- foram as principais produzidas, respectivamente, quando ocorreu o aumento da densidade de corrente, podendo ser usadas como agentes fortemente oxidantes da matéria orgânica. Por ser um estudo inovador onde não se tem nenhuma referência na literatura sobre a utilização do eletrodo de BDD nesse tipo de processo, a discussão dos resultados tornou-se muito restrita, mas comprometida em efetuar outras análises para definir os parâmetros necessários a uma discussão mais abrangente sobre a atuação do BDD nesse tipo de processo.
Agradecimentos
A CAPES pela bolsa de mestrado.
Referências
MARTINEZ-HUITLE, C.A., BRILLAS, E. Electrochemical alternatives for drinking water disinfection. Angew Chem Int Ed. 47, 1998–2005, 2008.
NEODO, S., ROSESTOLATO, D., FERRO, S., DE BATTISTI, A., Investigation on the active chlorine production from diluted chloride solutions and electrochemical reactivity of their side-products. Electrochimica Acta. 80, 282–291, 2013.
PANIZZA, M., CERISOLA, G. Electrochemical degradation of gallic acid on a BDD anode. Chem Rer. 109, 6541–6569, 2009.
SALAZAR, C., SIRÉS, I., ZAROR, C.A., BRILLAS, E. Treatment of a Mixture of Chloromethoxyphenols in Hypochlorite Medium by Electrochemical AOPs as an Alternative for the Remediation of Pulp and Paper Mill Process Waters Electrocatalysis. 4, 212–223, 2013.
SIRÉS, I., BRILLAS, E., OTURAN, M.A., RODRIGO, M.A., PANIZZA, M. Electrochemical advanced oxidation processes: today and tomorrow. A review. Environ Sci Pollut Res. DOI 10.1007/s11356-014-2783-1, 2014.










