ISBN 978-85-85905-10-1
Área
Ensino de Química
Autores
Mendes, A.M.V. (UFRPE) ; Freitas, L.A.B. (UFRPE) ; Gomes, R.L. (EREM-PCD) ; Batinga, V.T.S. (UFRPE)
Resumo
Esta pesquisa teve como objetivo analisar uma atividade experimental como estratégia didática para abordar a influência da temperatura na velocidade das reações químicas encontradas no nosso cotidiano. O experimento, acompanhado de questões, foi aplicado em uma turma do 2° ano do Ensino Médio de uma escola pública na cidade do Recife, Pernambuco. Os resultados mostraram que o experimento contribuiu para a introdução dos aspectos fenomenológicos, teóricos e representacionais na abordagem do conteúdo cinética química. Nas respostas do grupo as questões 3 e 4 se destacou o aspecto Fenomenológico e nas questões 1 e 2, observou-se a integração das três dimensões do conhecimento químico.
Palavras chaves
Temperatura; Cinética química; Ensino médio
Introdução
Giordan (1999) e Guimarães (2009) destacam que a experimentação desperta interesse entre os estudantes pela ciência, por estar vinculado aos aspectos fenomenológicos do conteúdo em pauta, tornando-o menos abstrato e podendo propiciar uma introdução motivadora que envolve os alunos e potencializa a capacidade de aprendizado. Para as Orientações Curriculares Nacionais (2006) a experimentação não pode ser resumida a uma simples observação de fenômenos, de modo mecânico, em detrimento de conteúdos químicos que dialogam entre conhecimentos teóricos e práticos. Em geral, os medicamentos que ingerimos para aliviar a azia precisam ser dissolvidos em água. Esses antiácidos possuem em sua composição uma base, que ao chegar ao nosso estomago reagem com o ácido clorídrico, neutralizando-o. Dessa forma cessa-se a azia. Muitas vezes passa despercebido que a própria dissolução do comprimido trata-se de uma reação química. Deste modo, se conhecermos a teoria das colisões e os fatores que influenciam na velocidade das reações químicas torna-se possível controlar a velocidade destas (MÓL; SANTOS, 1998). O emprego da temperatura pode acelerar/retardar a velocidade das reações químicas. Por exemplo, a utilização de baixas temperaturas diminui a intensidade da movimentação das moléculas, reduzindo os choques efetivos. De modo análogo, se dissolvermos um comprimido em água gelada a reação química ocorrerá lentamente. Portanto, o estudo da cinética química permite controlar as reações químicas. Com base nas questões discutidas, este trabalho objetiva analisar uma atividade experimental como estratégia didática para abordar a influencia da temperatura na velocidade das reações químicas.
Material e métodos
O experimento – Investigando a influência da temperatura nas reações químicas a partir da dissolução de comprimido efervescente – foi aplicado no laboratório de uma escola pública de Recife-PE, a 19 alunos do 2° ano do EM, em duas aulas geminadas, onde a turma foi dividida em cinco grupos denominados de G1, G2, G3, G4 e G5. Nesse trabalho optamos por analisar as respostas do grupo 5. O roteiro experimental constou do seguinte procedimento: Identifique cada um dos 3 béqueres de 100 mL com adesivo e caneta: água gelada, água à temperatura ambiente e água quente; Coloque 50 mL de água gelada, no béquer intitulado “água gelada”; Coloque 50 mL de água à temperatura ambiente, no béquer intitulado “água à temperatura ambiente”; Coloque 50 mL de água quente, no béquer intitulado “água quente”; Adicione simultaneamente, em cada um dos béqueres, 1 comprimido efervescente; Utilize o cronômetro e anote. Foram propostas quatro questões para resolução sobre o experimento: Q1. Em qual condição a dissolução do comprimido efervescente foi mais rápida? Explique quimicamente. Q2. Faça um desenho que represente os aspectos microscópicos relativos à dissolução do comprimido efervescente em cada condição de temperatura no experimento realizado. Q3. Você percebe a influencia da temperatura nas reações químicas observadas no dia a dia? Se positivo, descreva através de exemplos. Q4. O que você entende/conhece sobre os métodos de conservação de alimentos? Você usa algum método de conservação em sua casa? Quais? Adotamos como categorias de análise os aspectos do conhecimento químico: fenomenológico (FN), relacionado a fenômenos concretos e visíveis; teórico (TR) trata da natureza microscópica e representacional (RP), compreende a parte simbólica da química (Mortimer et al., 2000).
Resultado e discussão
Na Q1, a resposta do G5: “Na água à temperatura quente. Pois com a água quente
as moléculas estão mais dispostas a se movimentar, estarão mais agitadas”,
reflete o aspecto teórico (TR), por reconhecer que o aumento da temperatura está
relacionado à agitação das moléculas, ou seja, demonstra compreender que quanto
mais calor fornecido aos reagentes, maior será a agitação das moléculas devido o
aumento da energia cinética e consequentemente a reação será mais rápida. Na Q2
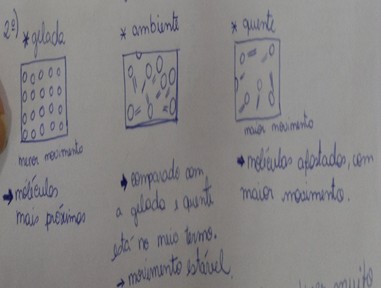
o G5 evidencia que reconhece o aspecto teórico (Figura 1), pois explica como
estão dispostas as moléculas em cada caso proposto na atividade experimental,
destaca à existência de espaço vazio entre elas e como se dá a movimentação
destas em cada condição de temperatura realizada no experimento. O G5 aborda
modelos de natureza atômico-molecular para explicar o comportamento cinético das
reações químicas propostas, ratificando que conseguem compreender o
comportamento abstrato das moléculas e explicar os fenômenos macroscópicos com
embasamento científico. A resposta do G5 a Q3 expressa aspectos macroscópicos,
embora respondam com um exemplo insatisfatório, visto que se trata de um
fenômeno físico, mudança de estado da água: “Quando chove, por exemplo, se o
chão estiver muito quente à água evapora com mais facilidade”. Na Q4, a resposta
do G5: “Com o ambiente gelado, conservando o alimento na geladeira, tenderá a
retardar o processo de amadurecimento, por isso o comprimido na água gelada
demora a dissolver”, revela que “ambiente gelado” retarda a velocidade das
reações químicas nos alimentos e cita uma generalização coerente, demonstrando
reconhecer os aspectos fenomenológicos (FN) em suas práticas cotidianas.
Conclusões
A experimentação contribuiu para a integração dos três aspectos do conhecimento químico. Nas respostas do G5 as Q3 e Q4 houve a predominância da dimensão FN. Na Q1 e Q2, houve integração das dimensões do conhecimento químico. Na Q3 temos evidenciado o que trata a literatura sobre dificuldades dos alunos em distinguir fenômenos físicos e químicos. A experimentação proposta permitiu ao grupo de alunos (G5) o desenvolvimento de habilidades relacionadas à observação, registro, ao “saber como” e a elaboração de hipóteses para solucionar as questões referentes ao experimento.
Agradecimentos
UFRPE, PIBIC/CNPq e EREM-PCD.
Referências
BRASIL. Ministério da Educação. Secretaria de Educação Básica. Orientações curriculares para o ensino médio: Ciências da natureza, matemática e suas tecnologias, v. 2, Brasília: MEC/SEB, 2006.
DE JONG, O. Los experimentos que plantean problemas em las aulas de Química: dilemas y soluciones. Enseñanza de las Ciências, v. 16, n. 2, p. 305-314, 1998.
GIORDAN, M. O papel da experimentação no ensino de ciências. Química Nova na Escola, São Paulo, n. 10, p. 43-49, nov. 1999.
GUIMARÃES, C. C. Experimentação no Ensino de Química: Caminhos e Descaminhos Rumo à Aprendizagem Significativa. Química Nova na Escola, São Paulo, v. 31, n. 3, p. 198-202, 2009.
MÓL, G. S.; SANTOS, W. L. P. Química na Sociedade (coord.). v.1, módulo 2. Brasília: Editora UnB, 1998.
MORTIMER, E. F.; MACHADO, A. H.; ROMANELLI, L. I. A proposta curricular de química do Estado de Minas Gerais: fundamentos e pressupostos. Química Nova, São Paulo, v. 23, n. 2, p. 27-38, 2000.










