ISBN 978-85-85905-10-1
Área
Produtos Naturais
Autores
Souza, C.A.G. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Siqueira, S.M.C. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Morais, S.M. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Vieira, (PADETEC) ; Azevedo, A.C.M. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Freire, A.L.F. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Gomes, R.N. (UNIVERSIDADE ESTADUAL DO CEARÁ)
Resumo
O objetivo deste trabalho é investigar a possível atividade acetilcolinesterase dos extratos hidroalcóolicos de quatro espécies do gênero Spondias. Os extratos foram feitos das folhas secas das quatro espécies, após a extração foram aplicados os testes de acetilcolinesterase. As amostras estudadas apresentam potencialidades frente à inibição da enzima acetilcolinesterase, porém, ainda são necessários estudos mais avançados para se afirmar que tais amostras poderão ser usadas no desenvolvimento de novos antiacetilcolinesterásicos.
Palavras chaves
Spondias; Acetilcolinesterase; Extrato
Introdução
A família Anarcadiaceae possui aproximadamente 76 gêneros e 600 espécies (VOGL e MITCHELL, 1996). Spondias mombin (cajá), Spondias tuberosa (cajarana ou umbu), Spondias tuberosa x S. mombin (cajá-umbu) e Spondias purpurea (siriguela), pertencem ao gênero Spondias que possui aproximadamente 30 espécies (MILLER e SCHAAL, 2005). Na medicina popular a espécie S. mombim, a decocção dos frutos é utilizada como diurético e a decocção das cascas e das folhas é utilizada no tratamento de disenteria e gonorréia. Ensaios biológicos mostraram que a casca do caule de S. mombin possui percentual de inibição das enzimas acetilcolinesterase-AChE de 60,71% e butirilcolinesterase-BuChE de 48,72% (ELUFIOYE et al., 2010). A acetilcolina (ACh) é um neurotransmissor biossintetizado a partir da acetil-coenzima (FRAGA et al., 2004).No cérebro está intimamente relacionada com as sinapses associadas ao controle motor, memória e cognição. Sendo a sua remoção da fenda sináptica, realizada através de uma reação de hidrólise, catalisada pela enzima acetilcolinesterase (AChE), que gera como produtos ácido acético e colina (VIEGAS JR. et al., 2004). Acredita-se que a inibição da acetilcolinesterase (AchE), gerada pela a ação de agentes chamados inibidores da enzima acetilcolinesterase (AChEIs), cause o aumento da concentração de ACh nas sinapses. Esta é uma das principais estratégias usadas para equilibrar o déficit colinérgico que está diretamente relacionado com a Doença de Alzheimer (DA). É válido citar que algumas pesquisas apontam drogas provenientes de produtos naturais como sendo possíveis AChEIs. Portanto, o objetivo deste trabalho é investigar a possível atividade acetilcolinesterase dos extratos hidroalcóolicos de 4 espécies do gênero Spondias.
Material e métodos
As folhas das espécies em estudo foram secas à temperatura ambiente e em seguida trituradas. Posteriormente, pesou-se 5 g de cada amostra de folhas e diluiu-se em 50 mL de solução, na proporção de 70:30 (etanol:água), em um erlenmeyer, ao qual foi adicionada uma barra magnética. Em seguida a mistura foi levada para um agitador magnético com aquecimento a uma temperatura de 70 ºC, no qual permaneceu por um período de três horas. Após esse período, a solução hidroetanólica foi filtrada diretamente em balão volumétrico, sendo completado o volume para 25 mL e transferido para um recipiente de vidro. O mesmo foi levado ao evaporador rotatório e ao banho-maria para retirada do solvente e obtenção do extrato bruto. A avaliação preliminar da atividade inibidora da enzima aceticolinesterase dos extratos hidro alcoólicos foi efetuada de acordo com o ensaio enzimático descrito por Ellman et al., (1961) e adaptado para cromatografia em camada delgada por Rhee et al., (2001). Este bioensaio consiste na aplicação das amostras em CCD, seguida da pulverização da placa com o reagente de Ellman (DTNB) e solução de iodeto de acetilcolina (ATCI) em tampão apropriado. Em seguida, pulveriza-se a placa com a enzima AChE (3 U mL-1).
Resultado e discussão
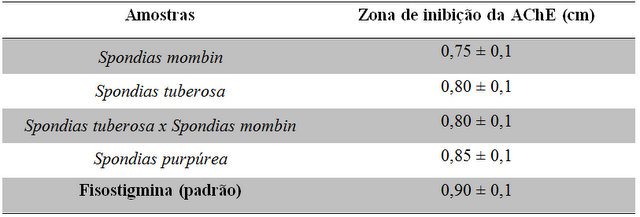
Os resultados que representam a atividade de inibição da enzima
acetilcolinesterase dos extratos dos gêneros Spondias estão na Tabela 1.
As amostras apresentaram capacidade de inibição da enzima acetilcolinesterase
muito próxima ao halo do padrão fisostigmina.
Conclusões
As amostras estudadas apresentam potencialidades frente à inibição da enzima acetilcolinesterase, porém, ainda são necessários estudos mais avançados para se afirmar que tais amostras poderão ser usadas no desenvolvimento de novos antiacetilcolinesterásicos.
Agradecimentos
Referências
ELUFIOYE, T. O.; OBUOTOR, E. M.; SENNUGA, A. T.; AGBEDAHUNSI, J. M.; ADESANYA, S. A. Acetylcholinesterase and butyrylcholinesterase inhibitory activityof some selected Nigerian medicinal plants. Brazilian Journal of Pharmacognosy, v.20, n.4, p.472-477, 2010.
CORTHOUT, J.; PIETERS, L.; CLAEYS , M.; GEERTS, S.; VANDEN BERGHE ,D.; VLIETINCK A. Antiviral ellagitannins from Spondias mombin. Phytochemistry, v.30, p.1129-30, 1991.
ELLMAN, G. C; COURTNEY, K. D.; ANDRES, V.; FHEATHERSTONE, R.M.A.New and rapid colorimetric determination of acetylcolinesteraseactivity. Biochemical Pharmacology, v. 7, p. 88-95, 1961.
FRAGA, C. A. M.; BARREIRO, E. J.; VIEGAS, C. J.; BOLZANI, V. S.; FURLAN, M. Produtos naturais como candidatos a fármacos úteis no tratamento do mal de Alzheimer. Química Nova, v. 27, p.655-660, 2004.
RHEE, I. K.; MEENT, M. V; INGKANINAN, K.; VERPOORTE, R. Screening for acetylcholinesterase inhibitors from Amaryllidaceae using silica gel thin-layer chromatography in combination with bioactivity stainin. Journal of Chromatography A, v. 915, p. 217-223, 2001.
VOGL, O.; MITCHELL, J. D. Botany and chemistry of the active components of poisonous Anacardiaceae. Journal of Macromolecular Science Part A Pure and Applied Chemistry, v. 33, p.1581–1599, 1996.
VIEGAS J. R. C.; BOLZANI, V. S.; FURLAN, M. Produtos naturais como candidatos a fármacos úteis no tratamento do mal de Alzheimer. Química Nova, v.27, p. 655-660, 2004.










