ISBN 978-85-85905-10-1
Área
Produtos Naturais
Autores
Feitoza Costa,, E. (UECE) ; Liberato,, M.C.T.C. (UECE) ; Maciel de Oliveira Silva,, M. (UECE)
Resumo
Amostras de própolis vermelha de Apismellifera da cidade de Caravelas na Bahia foram analisadas para determinação de flavonoides, atividade antioxidante e teor de fenóis totais. Foram obtidos extratos metanólico e etanólico da própolis através de Soxhlet. Na atividade antioxidante foi usado o teste do DPPH, obtendo- se para as amostrasde extratos metanólico e etanólico, IC50 =2,56±0,07mg/mLe IC50 = 2,62±0,11mg/mLrespectivamente.O extrato metanólicomostrou a melhor atividade antioxidante e apresentou mais alto teor de fenóis totais (75,10±0,55 mgEAG/100g).
Palavras chaves
própolis vermelha; atividade antioxidante; Compostos fenólicos
Introdução
A própolis é formada por constituintes aromáticos e resinosos, coletados por abelhas a partir das flores, brotos, ramos, exsudatos de árvores e pólen(SILVA et al 2006).A própolis pode apresentar-se com diferentes cores variação essa devida à sua origem floral. A própolis vermelha é típica de manguezais e tem como origem floral a planta comumente chamada de “rabo de bugio” (Dalbergiaecastophylium). Embora possa se originar a partir de diferentes origens florais a grande maioria das própolis tem a mesma natureza química, compondo-se de 50% de resina (flavonoides e ácidos fenólicos), 30% de cera, 10% de óleos essenciais, 5% de pólen e 5% de outros constituintes orgânicos (GÓMEZ- CARAVACA et al., 2006). Na área farmacológica, a própolis vem mostrando importantes propriedades biológicas. É possível que um sinergismo dos muitos compostos, seja o responsável pelas atividades biológicas da própolis (MARCUCCI, 1996). Pesquisadores no mundo inteirotêm descritovárias propriedades biológicas, entre elas a atividade antioxidante em extratos de própolis, que possivelmente tem como responsável seu alto teor de flavonoides.
Material e métodos
Foram usadas amostras de própolis de Apismellifera originária da cidade de Caravela - Ba e com origem botânica predominante da planta “Rabo de bugio”. As amostras foram extraídas em etanol e metanol, no aparelho de Soxhlet, para execuções das análises. Determinação de Fenóis Totais: Inicialmente uma curva padrão de ácido gálico foi construída. Alíquotas de 2 a 9 mL de solução aquosa de ácido gálico foram transferidas para balões de 25 mL, onde continha cerca de 70% de água destilada. Foram acrescentados 5 mL do reagente de Folin-Ciocalteau e após 2 min, 1 mL de solução de carbonato de sódio.Da mesma forma o branco foi feito, no entanto sem a alíquota da amostra. Foram deixadas em repouso à temperatura ambiente e após 30 min, as soluções foram a leitura em espectrofotômetro a 760nm (FUNARI e FERRO, 2006). Indicação da Atividade Antioxidante: Foi medido pelo método do DPPH (1,1-difenil-2-picrilhidrazil). Em tubos de ensaios, foram colocadas 3,9mL de uma solução metanólica de radical DPPH. Por seguinte foi adicionada ao tubo 0,1mL da solução etanólica e metanólica da amostra (0,1g/mL) a ser avaliada. A absorbância foi lida no espectrofotômetro no comprimento de onda de 515nm. A atividade antioxidante da amostra foi determinada por da sua tendência de capturar o radical DPPH. Ácido Ascórbico foi usado como padrão (BLOIS, 1958). Caracterização de flavonoides: De início uma curva padrão de quercetina foi feita. Alíquotas de 2 a 6 mL de solução etanólica de quercetina, a 50 μl/mL, foram transferidas para balões de 25 mL, com 1 mL de solução de AlCl3 a 2,5%. Branco do sistema, 1 mL da solução aquosa de AlCl3 diluído, em balão de 25mL foi usada. Depois de 30 min, foi realizada a leitura das soluções a 425nm, em espectrofotômetro (FUNARI e FERRO, 2006).
Resultado e discussão
A origem botânica e a região da coleta influenciam diretamente na composição da
própolis. O teor de Fenóis Totais do extrato etanólico e metanólico foi de
35,93±0,49 mg/EAG/100g e 75,10±0,55 mg/EAG/100g respectivamente. O extrato
metanólico da própolis vermelha apresentou teor de compostos fenólicos, superior
ao do extrato etanólico, mostrando parâmetros de acordo com o que a literatura
indica, ou seja,a abundância de compostos bioativos nela presentes. Os
resultados para a atividade antioxidante foram de 2,62±0,11mg/ml para o extrato
etanólico e 2,57±0,07 mg/ml para o extrato metanólico comprovando a literatura,
que mostra que quanto maior o teor de fenóis totais, menor será o valor numérico
do IC50 o que significa que maior será a atividade antioxidante.A caracterização
quantitativa dos flavonoides foi realizada pelo método do AlCl3 que baseia-se na
formação de um complexo entre o íon alumínio Al (III) e os grupos carbonila e
hidroxila dos flavonoides, este indicado pela cor amarela. Nesse método há um
deslocamento para um maior comprimento de onda e intensificação de suas bandas
de absorções. Os resultados apresentaram valores de 8,94±0,13 e
9,71±0,13mgQE/100g para os extratos etanólico e metanólico da própolis vermelha
respectivamente. As análises foram feitas em triplicata e os resultados
encontram-se na Tabela 1.
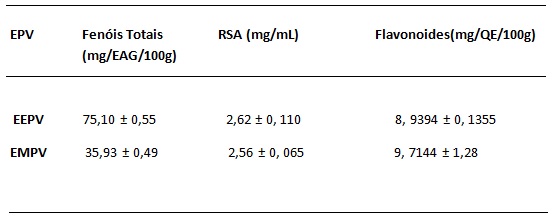
Fenóis totais, atividade antioxidante e teor de flavonoides nos EEPV (extrato etanólico da próp. verm) e EMPV(extrato metanólico da própolis vermelha)
Conclusões
As amostras de própolis estudadas mostram valores conforme a literatura. Os resultados concernentes aos teores de fenóis, para o extrato metanólico da própolis vermelha mostraram-se mais elevados do que os encontrados no extrato etanólico,bem como o teor de flavonoides e a atividade antioxidante o que está de acordo com pesquisadores que apontam o teor de flavonoides como responsáveis pela atividade antioxidante. Os resultados apresentados abrem a perspectiva do uso dos produtos originados da própolis, tendo em vista seus compostos bioativos e suas atividades antioxidantes.
Agradecimentos
A Universidade Estadual do Ceará, ao Laboratório de Bioquímica e Biotecnologia, pelo espaço para a realização da pesquisa e ao CNPq.
Referências
BLOIS, M.S. ANTIOXIDANT DETERMINATIONS BY THE USE OF A STABLE FREE RADICAL. Nature, 181, 1199–1200; 1958.
FUNARI CS, FERRO VO 2006. Análise de Própolis. CiêncTecnolAliment 26: 171-178
GOMEZ-CARAVACA, A. M., GOMEZ-ROMERO, M., ARRAEZ-ROMAN, D., SEGURA-CARRETERO, A. FERNANDEZ-GUITIERREZ, A. Advances in theanalysisofphenoliccompounds in productsderivedfrombees. JournalofPharmaceuticalandBiomedicalAnalysis v. 41. p. 1220-1234. 2006.
MARCUCCI, M. C. Propriedades biológicas e terapêuticas dos constituintes químicos da própolis. Química Nova, v. 19, p. 529-536, 1996.
MATOS, F.J.A. Introdução à fitoquímica experimental. 3.ed. Editora da Universidade Federal do Ceará. Fortaleza: UFC, 1998. 141p.
Park, Y. K.; Alencar, S. M.; Aguiar, C. L., 2002. Botanical origin and chemical composition of Brazilian propolis. J. Agric. FoodChem. 50, 2502-2506.
SILVA, R. A.; RODRIGUES, A. E.; RIBEIRO, M. C. M.; CUSTODIO A. R.; ANDRADE, N. E. D.; PEREIRA,
SOUSA, J. P. B.; FURTADO, N.; JORGE, R.; SOARES, A. E. E. Revista Brasileira de Farmacognosia, v. 17, n. 1, p. 85 – 93, 2007.
W. E. Características físico-químicas e atividadeantimicrobiana de extratos de própolis da Paraíba, Brasil. Ciência Rural, Santa Maria, v. 36, n. 6, p. 1842-1848, 2006.










