ISBN 978-85-85905-10-1
Área
Produtos Naturais
Autores
Cunha, A.C.L. (UFMT) ; Guimarães, D.B. (UFMT) ; Cavalheiro, L. (UFMT) ; Gomes, T.O. (UFMT) ; Sinhorin, A.P. (UFMT) ; Vieira Júnior, G.M. (UFMT)
Resumo
O presente trabalho abordará análises fitoquímicas do extrato etanólico e suas fases: hexânica, etérea, acetato de etila e metanol/água das folhas de Caesalpinia peltophoroides, bem como atividade antioxidante e toxicidade destes extratos. Foram realizados testes fitoquímicos clássicos, atividade antioxidante frente ao radical DPPH e teste de toxicidade frente a Artemia salina. Com base nos resultados obtidos verificou-se a presença de esteroides, terpenoides, flavonoides, taninos, saponinas e alcaloides. A fase etérea apresentou maior atividade antioxidante com CE50 de 19,14 g/mL superando o controle positivo quercetina (CE50 de 37,07 g/mL). No ensaio toxicológico, todos os extratos testados apresentaram uma dose letal média superior a 1000 g/mL sugerindo a não toxicidade dos mesmos.
Palavras chaves
C. peltophoroides; análise fitoquímica; atividades biológicas
Introdução
O segundo maior número de plantas medicinais em todo o mundo pertence à família Fabaceae (GAO et al., 2010). Destas, encontram-se no Brasil mais de 210 gêneros e 2694 espécies. Um de seus membros a Caesalpinia peltophoroides Benth. conhecida popularmente como “Sibipiruna”, “Sebipira” e “Falso Pau-Brasil” e encontrada principalmente na Mata Atlântica e há também exemplares no sul da Bahia e grandes populações no Pantanal Mato-Grossense (LORENZI, 2002). C. peltophoroides é uma semidecídua, heliófita, indiferente às condições físicas do solo. Floresce de setembro a novembro, despontando inflorescências eretas e cônicas, do tipo espiga ou cacho e com numerosas flores amarelas que abrem gradualmente da base em direção ao ápice. É uma árvore muito utilizada para arborização urbana (LORENZI, 2002). C. peltophoroides conta com um potencial uso para a madeira (CORTE et al., 2008) e sua casca é usada popularmente para tratar disenteria e a literatura relata estudos sobre a atividade antimalárica (BAELMANS et al., 2000). Em virtude da escassez de estudos químicos e farmacológicos de C. peltophoroides, o presente trabalho teve como objetivo avaliar qualitativamente os constituintes químicos das folhas de C. peltophoroides, avaliar a atividade antioxidante e determinar a toxicidade frente a A. salina do extrato etanólico e das frações hexânica, etérea, acetato de etila e metanol/água obtidas a partir das folhas de C. peltophoroides.
Material e métodos
As folhas de C. peltophoroides foram coletadas na cidade de Sinop-MT e uma exsicata foi depositada no ABAM-UFMT, no campus de Sinop. As folhas foram secas, trituradas e extraídas com etanol. O extrato etanólico (EE) foi submetido a partições com hexano, éter e acetato de etila. O extrato etanólico e todas as fases foram submetidos a testes fitoquímicos, realizados em triplicata, para verificação da presença de esteroides e terpernoides, fez-se a reação de Lieberman-Burchard, flavonoides, pelo teste de Cianidina ou Shinoda, taninos e fenóis, pela reação com cloreto férrico, saponinas, alcaloides, através dos reativos Dragendoorf, Bouchardt e Mayer, polissacarídeos, pela reação com Lugol e purinas, pela reação com HCl (TEIXEIRA et al., 2012). Para a realização do ensaio toxicológico, adicionou-se à solução salina 10 mg de ovos de A. Salina. Realizou-se o ensaio em triplicata e a cada frasco adicionou-se concentrações dos extratos de 1000 ppm, 100 ppm, 10 ppm e 1 ppm. Adicionou-se aos frascos 10 náuplios e 5 mL de solução salina. Preparou-se também um grupo controle sem a presença dos extratos. Após um período de exposição de 24 horas realizou-se a contagem do número de náuplios sobreviventes no grupo controle e nos grupos expostos aos extratos. A atividade antioxidante do extrato das folhas foi realizada avaliando a atividade sequestradora do radical livre DPPH. Preparou-se 50 mL de solução estoque de DPPH em metanol na concentração de 40 μg/mL. Foram feitas diluições de 35, 30, 25, 20, 15, 10, 5 e 1 μg/mL. A curva de calibração foi construída a partir dos valores da absorbância a 515 nm de todas as soluções (1 a 40 μg/mL) e tendo como “branco” o metanol. As medidas de absorbância foram efetuadas em triplicata e foi realizada a leitura após 30 min (SOUSA et al., 2007).
Resultado e discussão
A triagem fitoquímica feita nas folhas de C. peltophoroides apresentou resultados que foram considerados positivos pela formação de precipitados e/ou surgimento de coloração e/ou espuma, sendo classificados em fraco, positivo e negativo, de acordo com a presença ou ausência dos mesmos (Tabela 1). No extrato EE e na FH foram detectados a presença de terpenos e esteróides, na fase FA e FMA foi detectada a presença de saponinas. Alcaloides foram detectados no extrato EE e na fase FE, enquanto que taninos e fenóis foram detectados em todos os extratos e fases analisados, mostrando assim a grande diversidade de metabólitos presentes nas folhas de C. peltophoroides.
O teste toxicológico apresentou um número não considerável de óbitos para as diferentes fases e extrato etanólico. A análise estatística dos resultados, com base na determinação da dose letal média (DL50) do ensaio toxicológico apresentou valores maiores que 1000 ppm para todas as frações analisadas, não mostrando, então, toxicidade para as mesmas.
A atividade antioxidante das fases FH, FE e FA apresentaram valores de CE50 de 24,85; 19,14 e 36,32 μg/mL, respectivamente, valores estes que foram inferiores ao padrão quercetina (CE50 = 37,06 μg/mL) (Figura 1). Este resultado é um bom indicativo da presença de substâncias antioxidantes presentes nas frações.
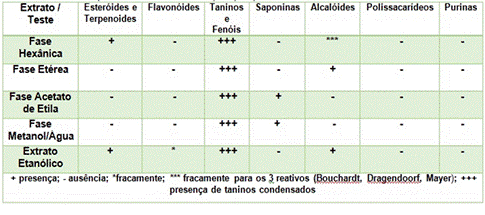
Análise fitoquímica das folhas de Caesalpinia peltophoroides
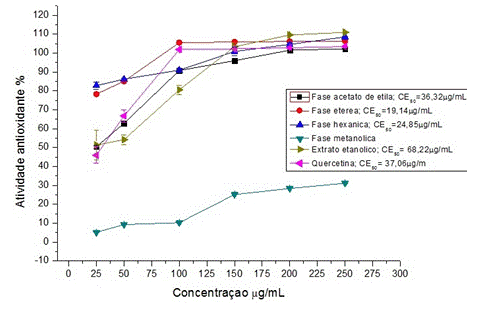
Atividade antioxidante das folhas de Caesalpinia peltophoroides
Conclusões
Através dos testes fitoquímicos observou-se principalmente a presença de taninos e fenóis em todas as frações e extrato analisados. O extrato e as frações não apresentaram grau significativo de toxicidade frente a A. salina. O EE, FH, FE e FA mostraram uma alta capacidade de sequestro do radical livre DPPH, esses resultados podem ser usados para futuros estudos de identificação e isolamento das substâncias responsáveis por esta atividade, podendo estar relacionada à presença de taninos e fenóis de acordo com a análise fitoquímica.
Agradecimentos
À UFMT pelo suporte financeiro e laboratorial.
Referências
(BAELMANS, R.; DEHARO, E.; BOURDY, G.; MUÑOZV, V.; QUENEVO, C.; SAUVAIN, M.; GINSBURG, H. A search for natural bioactive compounds in Bolivia through a multidisciplinary approach; Part IV. Is a new haem polymerisation inhibition test pertinent for the detection of antimalarial natural products? Journal of Ethnopharmacology, no 73, 271-275, 2000)
(CORTE, V. B.; BORGES, E. E. L.; VENTRELLA, M. C.; LEITE, I. T. A.; BRAGA, J. T. Histochemical aspects of reserves mobilization of Caesalpinia peltophoroides (Leguminosae) seeds during germina tion and seedlings early growth. Árvore, no 32, 641-650, 2008)
(GAO, T.; YAO, H.; SONG, J.; LIU, C.; ZHU, Y.; MA, X.; PANG, X.; XU, H.; CHEN, S. Identification of Medicinal Plants in the Family Fabaceae using a Potential DNA Barcode ITS2 Journal of Ethnopharmacology, no 130, 116, 2010)
(LORENZI, HARRI, 1949 – Árvores brasileiras manual de identificação e cultivo de plantas arbóreas do Brasil, vol.1 / Harri Lorenzi. – 4. ed.—Nova Odessa, SP: Instituto Plantarum, 2002)
(SOUSA, C. M. M; SILVA, H. R; VIEIRA JUNIOR, G. M; AYRES, M. C. C; COSTA, L. S; ARAÚJO, D. S; CAVALCANTE, L. C. D; BARROS, E. D. S; ARAÚJO, P. B. M; BRANDÃO, M. S; CHAVES, M. H. Fenóis totais e atividade antioxidante de cinco plantas medicinais. Quimica nova, no 30, 351-355, 2007)
(TEIXEIRA, L. N; LIMA, M. A; SILVA, M. J. M; CARVALHO, L. F. M. Screening fitoquímico e avaliação de captura de radical DPPH pelos extratos de Manilkara sapota L. VII CONNEPI, Palmas – TO, 2012)










