ISBN 978-85-85905-10-1
Área
Produtos Naturais
Autores
Melo, A.S. (UFPE) ; Silva, C.D. (UFPE) ; Costa, J.A. (UFPE) ; Silva, D.G.R. (UFPE) ; Sá, R.A. (UFPE)
Resumo
O presente trabalho relata a avaliação da atividade inseticida do extrato salino (ES8), fração proteica (F4) e lectina (PII) das entrecascas de Stryphnodendron adstringens frente à espécie Sitophilus zeamais. Lectinas foram detectadas no ES8, estimulando seu isolamento e purificação. ES8 e F4 são termicamente resistentes e aglutinaram eritrócitos de todos os tipos sanguíneos do sistema ABO, assim como eritrócitos glutarizados de coelho. F4 apresentou maior AHE e foi inibida com N-acetilglicosamina, que estimulou a purificação da lectina (PII) através de cromatografia de afinidade em coluna de quitina. Nenhuma das amostras proteicas testadas apresentou atividade inseticida apreciável contra S. zeamais.
Palavras chaves
S. adstringens; Lectinas; Sitophilus zeamais
Introdução
O milho é um dos cereais mais importantes cultivados no mundo todo. É uma planta gramínea da espécie Zea mays L., um cereal de alto teor nutritivo cultivado há muitos séculos (GALLO et al., 2002). O armazenamento dos seus grãos é dificultado devido à grande gama de pragas que podem atacá-los. A espécie Sitophilus zeamais (Curculionidae), conhecida como gorgulho do milho, é uma das suas principais pragas (GALLO et al., 2002). A preocupação com o uso de substâncias químicas de alta toxicidade ao ambiente tem levado à busca por substâncias naturais com ação sobre organismos xilófagos, não-tóxicas ao homem e a outros animais (AHMED et al., 2006), tais como as lectinas, que são proteínas que interagem seletiva e reversivelmente com monossacarídeos e glicoconjugados (LIS & SHARON, 1986). Comumente extraídas de folhas, sementes e entrecascas de vegetais, as lectinas apresentam várias propriedades biológicas (inseticida, antifúngica, antimicrobiana e antitumoral, p. ex.)em função de sua especificidade (VAN DAMME et al., 1998). Stryphnodendron adstringens (Leguminosae-Mimosoidae), o "barbatimão", é uma árvore de pequeno porte nativa do cerrado brasileiro que se destaca pelo elevado teor de taninos presentes em sua casca (DI STASI et al., 2002). Na medicina popular, a infusão de sua casca é utilizada externamente como anti-inflamatória e cicatrizante, e internamente na cura de úlceras (LORENZI & MATOS, 2002). Deste modo, objetivou-se avaliar a ação inseticida das preparações proteicas de S. adstringens frente à espécie S. zeamais , a fim de investigar seu potencial biotecnológico e estimar sua contribuição para o controle desta praga.
Material e métodos
Cerca de 10 g de farinha da entrecasca de S. adstringens foram submetidos à extração de proteínas em NaCl 0,15 M por 8h (ES8). A atividade lectínica de ES8 foi realizada em placas de microtitulação. Foram colocados 50µl de NaCl 0,15M em cada poço; em seguida, foram adicionados ao segundo poço 50 µl da amostra a ser avaliada. Após uma diluição seriada, 50µl de eritrócitos de coelhos foram adicionados em todos os poços e as placas foram incubadas por 45 minutos. ES8 foi avaliado quanto à presença de proteínas por espectrofotometria através do método de LOWRY et al. (1951). A purificação inicial foi realizada com o fracionamento das proteínas de ES8 com (NH4)2SO4 segundo GREEN & HUGHES (1955). Em seguida, F4 foi submetido à diálise exaustiva com H2O e NaCl 0,15 M por 4h cada, e posteriormente avaliado na presença de carboidratos e glicoproteínas. Em seguida, F4 foi aplicado em coluna de quitina, equilibrada com NaCl 0,15 M. O pico proteico ativo (PII), denominado Lectina de S. adstringens, foi eluído com Ácido acético 1,0 M, submetido à diálise exaustiva com H2O (4h) e liofilização. A atividade inseticida foi realizada de acordo com o método de XIE et al. (1995), utilizando as amostras concentradas de ES8, F4 e PII (90, 50 e 1 mg/mL, respectivamente). Foram calculados os índices nutricionais: 1) taxa de crescimento relativo (TCrR): (biomassa adquirida)/(biomassa inicial dos insetos x dias); 2) taxa de consumo relativo (TCoR): (massa ingerida)/(biomassa inicial dos insetos x dias); 3) eficiência de conversão do alimento ingerido (ECAI): ([biomassa adquirida / massa ingerida] x 100).
Resultado e discussão
ES8 apresentou AH e concentração proteica satisfatória, obtendo AHE =
364 mg/mL. A partir de ES8, a purificação parcial das proteínas com
(NH4)2SO4 foi realizada, gerando 4 frações
proteicas. A fração F4, por apresentar a melhor AHE (270034,0), foi
escolhida para continuação do processo de purificação da lectina de S.
adstringens. ES8 e F4 aglutinaram eritrócitos glutarizados
do sistema ABO e de coelho. O ensaio de termoestabilidade indicou que
ES8 e F4 sofreram leves perdas de AH de 30-100°C. Foi
observado que os cátions divalentes de Mg, Mn e Ca (10mM e 20mM) estimularam o
aumento da AH de ES8 e F4. Observou-se também que
F4 inibiu alguns dos carboidratos testados e todas as glicoproteínas
testadas. PII foi avaliado em função da AH, sendo denominado lectina de S.
adstringens. Na determinação de atividade inseticida, as preparações proteicas
de S. adstringens não apresentaram toxicidade satisfatória. Os dados de TCrR,
TcoR e ECAI foram sistematizados nos gráficos 1, 2 e 3, respectivamente. A
ingestão das amostras proteicas resultaram em TCrRs negativas em relação ao
controle, indicando perda de biomassa pelos insetos. As TCoRs obtidas para as
três amostras demonstraram biomassa consumida próximas a 50% do controle,
evidenciando a não-interferência do solvente na atividade e rejeição ao alimento
tratado com as amostras proteicas, fator atribuído à mortalidade dos insetos. As
ECAIs obtidas para as amostras testadas refletiram o prejuízo nutricional
causado. A leve toxicidade pode ser justificada pela inativação da N-
acetilglicosamina encontrada no trato digestivo de muitos insetos (LERNER e
RAIKHEL, 1992).
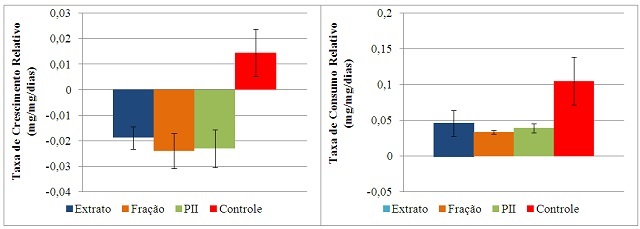
TCrR e TcoR de S. zeamais para o ES8, F4, PII e controle negativo com NaCl 0,15M.
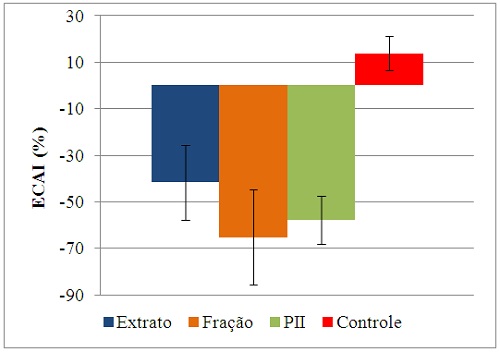
ECAI (%) de S. zeamais para o ES8, F4, PII e controle negativo com NaCl 0,15 M.
Conclusões
Diante dos resultados obtidos, concluiu-se que lectinas foram detectadas em S. adstringens através de ES8. ES8 e F4 mostraram-se termorresistentes, aglutinaram todos os tipos sanguíneos do sistema ABO e também eritrócitos de coelho, e tiveram sua AH estimulada pelos cátions divalentes. F4 mostrou afinidade com a N- acetilglicosamina, justificando posteriormente a ação inseticida desta e da lectínicas. Na atividade inseticida, concluiu-se que nenhuma das amostras proteicas induziu mortalidade expressiva contra S. zeamais nas concentrações testadas, inviabilizando seu uso no combate destes.
Agradecimentos
À PROPESQ-CNPq pelo apoio financeiro e à Profa. Dra. Patrícia Maria Guedes Paiva, coordenadora do Lab. de Glicoproteínas do CCS-UFPE - campus Recife.
Referências
AHMED, S. et al. Response of Microtermes obesi (Isoptera: Termitidae) and its gut bacteria towards some plant extracts. Journal of Food, Agriculture & Environment 4, 317-320, 2006.
DI STASI, L. C.; OLIVEIRA, G. P.; CARVALHAES, M. A.; QUEIROZ, M.; TIEN, O. S.; KAKINAMI, S. H.; REIS, M. S. Medicinal plants popularly used in the Brazilian Tropical Atlantic Forest. Fitoterapia 73: 69-91, 2002.
LERNER, D.R.; RAIKHEL, N. V. The gene for stinging nettle lectin (Urtica dioica agglutinin). Journal of Biological Chemistry, v. 267, n. 16, p. 11085-11091, 1992.
LIS, H.; SHARON, N. Lectins as molecules and as tools. Annual Rev. Biochemistry, 1986; 55: 35–67.
LORENZI, H.; MATOS, F. J. A. Plantas Medicinais do Brasil - Nativas e Exóticas. Ed. Plantarum, 2ª Ed., 2008.
LOWRY, O.H et al. Protein measurement with the Folin phenol reagent. Journal of Biological Chemistry 193, 265–275, 1951.
GALLO, D.; NAKANO, O., SILVEIRA NETO, S.; CARVALHO, R.P.L.; BATISTA, C.G. DE; BERTI FILHO, E.; PARRA, J.R.P.; ZUCCHI, R.A.; ALVES, S.B.; VENDRAMIM, J.D. Entomologia Agrícola. Piracicaba: FEALQ, 2002. 920p.
GREEN, A. A.; HUGHES, W. L. Protein fractionation on the basis of solubility in aqueous solutions of salts and organic solvents. In: COLOWICK, S.; KAPLAN, N. Methods in Enzymology, New York: Academic Press, v.1, pp. 67-90, 1995.
VAN DAMME, E. J. M.; PEUMANS, W. J.; BARRE, A.; ROUGÉ, P. Plant lectin: a composite of several distinct families of structurally and evolutionary related proteins with diverse biological roles. Plan. Science. v. 17, p. 575-692, 1998.
XIE, Y.S.; FIELDS, P.G.; ISMAM, M.B. Repellency and toxicity of azadirachtin and neem to three stored-product beetles. Journal of Economic Entomology, v.88, p.1024-1031, 1995.










