ISBN 978-85-85905-10-1
Área
Produtos Naturais
Autores
Wyrepkowski, C.C. (IFFARROUPILHA/UNESP) ; Sinhorin, A.P. (UFMT) ; Silva, A.C.Z. (UNESP) ; Costa, D.L.M.G. (UNESP) ; Santos, L.C. (UNESP)
Resumo
A pesquisa teve o objetivo de determinar a atividade antiradicalar e o teor de fenóis e flavonoides totais do extrato etanólico das cascas do caule de Caesalpinia ferrea. O extrato foi obtido por maceração etanólica. Para realização do teste antioxidante usou-se o DPPH (1,1-difenil-1-picril-hidrazila) e para determinação de compostos fenólicos e flavonoides realizaram-se os testes do Folin-Ciocalteu e do cloreto de alumínio. O ensaio antiradicalar evidenciou que o extrato possui atividade próxima do padrão quercetina. O teor de flavonoides totais equivalente a quercetina e de fenóis totais equivalente ao ácido gálico foram 137,03 e 480,00 mg/g de extrato, respectivamente. Portanto, o extrato desta espécie possui potencial antioxidante significativo e altos teores de compostos fenólicos.
Palavras chaves
Caesalpinia ferrea; antiradicalar; compostos fenólicos
Introdução
Nos últimos anos, os compostos fenólicos tem sido de grande interesse para indústria alimentar e farmacêutica por causa dos seus efeitos benéficos sobre a saúde humana. Os compostos fenólicos são conhecidos como metabólitos secundários e são amplamente distribuídas em cereais, frutas, ervas, legumes e outras plantas comestíveis (PEREIRA et al., 2012). Os compostos fenólicos exercem propriedades benéficas na saúde e atuam como antioxidante, anticancerígena e antidiabéticos (ABDALLAH et al., 2011; LEE et al., 2005). Geralmente, os compostos fenólicos são classificados em dois grupos principais de metabólitos: não flavonoídicos e flavonoídicos. As estruturas químicas apresentam hidroxilas e anéis aromáticos, contribuindo para as propriedades antioxidantes (MOURE et al., 2001). Os antioxidantes possuem a capacidade de proteger o organismo dos radicais por seqüestro dos mesmos pelas substâncias produzidas pelo organismo ou obtidas através da alimentação (GALIZIA et al., 2001). Assim, a presente pesquisa visou determinar a atividade antiradicalar e o teor de fenóis e flavonoides totais do extrato etanólico das cascas do caule de Caesalpinia ferrea.
Material e métodos
O extrato etanólico das cascas do caule de C. ferrea foi obtido pelo processo de maceração, seguido de rotaevaporação. O potencial antiradicalar foi avaliado por meio de um ensaio espectrofotométrico, de acordo com metodologia descrita por Pauletti et al. (2003). Amostras do vegetal e dos padrões (quercetina e ácido gálico) foram preparadas nas concentrações de 6,25; 12,5; 25,0; 50,0; 100,0 e 200,0 μg mL-1. As soluções foram constituídas de 20 µL da amostra acrescido de 200 µL da solução de DPPH. Após 30 minutos de reação, as absorbâncias das soluções foram medidas a 517 nm. Para a determinação do teor de fenóis totais foi utilizado o método espectrofotométrico (λ = 750 nm), fazendo uso do reagente Folin-Ciocalteau, segundo metodologia já descrita na literatura, os valores de fenólicos totais foram expressos como equivalentes de ácido gálico (EAG) (KÄHKÖNEN, et al. 1999). A determinação dos flavonoides totais foi realizada a partir do método colorimétrico no qual ocorre a complexação dos flavonoides com cloreto de alumínio de acordo com metodologia padrão de Peixoto SOBRINHO et al. (2008) modificado, onde a quercetina foi utilizada como padrão (EQ). Todos os procedimentos foram realizados em triplicata.
Resultado e discussão
A determinação de fenóis totais foi feita com uma curva de calibração,
utilizando como padrão o ácido gálico. O resultado obtido foi de 480,00 mg por g
de extrato (EAG). O extrato avaliado apresentou altos teores de compostos
fenólicos, quando comparados a dados de outras espécies descritos na literatura
(ROBY et al., 2013). Para a determinação de flavonóides totais, foi feita uma
curva de calibração, utilizando como padrão a quercetina. O resultado obtido foi
de 137,03 mg por g de extrato (EQ). A habilidade do antioxidante em sequestrar o
radical livre do extrato etanólico das cascas do caule de C. ferrea é
apresentado na Figura 1. Estudo realizado utilizando o teste de DPPH revelou que
a atividade antiradicalar do extrato (CE50 = 55,43 ± 0,34 μg.mL-1) foi muito
significativa quando comparada com os padrões de quercetina (CE50 = 48,80 ± 0,82
μg.mL-1) e ácido gálico (CE50 = 21,80 ± 1,23 μg.mL-1). Foi observado que o
extrato, tem praticamente o mesmo potencial do padrão da quercetina. O efeito
antiradicalar do extrato etanólico das cascas do caule deve-se, provavelmente ao
grande conteúdo de fenóis totais. Sousa et al. (2007), descreve que na maioria
dos extratos a atividade antiradicalar está correlacionada com a presença de
fenóis.
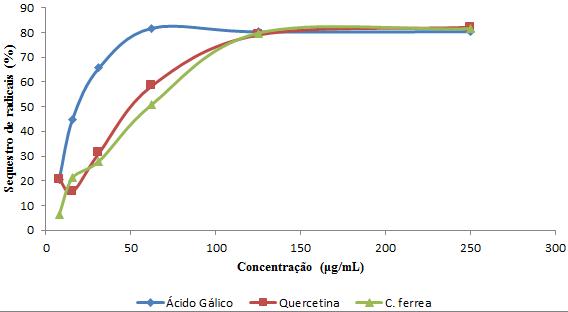
Porcentagem de inibição de DPPH do extrato etanólico de C .ferrea e dos padrões quercetina e ácido gálico.
Conclusões
O teor de flavonoides totais (EQ) e de fenóis totais (EAG) foram 137,03 e 480,00 mg por g de extrato, respectivamente. Portanto, apresentou alto teor de compostos fenólicos. O ensaio antiradicalar por DPPH evidenciou que o extrato etanólico das cascas do caule de C. ferrea, possui atividades muito próxima do padrão quercetina e inferior ao ácido gálico.
Agradecimentos
FAPESP, CNPq, CAPES,IF FARROUPILHA.
Referências
ABDALLAH, H.M.; SALAMA, M.M.; ABD-ELRAHMAN, E.H.; EL-MARAGHY, S.A. 2011. Antidiabetic activity of phenolic compounds from Pecan bark in streptozotocininduced diabetic rats. Phytochemistry Letters, 4: 337–341.
GALIZIA, M.S.; WAITZBERG, D.L. 2001. Mecanismos de ação dos radicais livres e antioxidantes. Revista Brasileira de Nutrição Clínica. 16 (2): 79-89.
KÄHKÖNEN, M.P.; HOPIA, A.I.; VUORELA, H.J.; RAUHA, J.P.; PIHLAJA, K.; KUJALA, T.S.; HEINONEN, M. 1999. Antioxidant activity of plant extracts containing phenolic compounds. Jounal of Agricultural and Food Chemistry,47: 3954-3962.
LEE, C.H.; YANG, L.; XU, J.Z.; YEUNG, S. Y.V.; HUANG, Y.; CHEN, Z.Y. Relative antioxidant activity of soybean isoflavones and their glycosides. 2005. Food Chemistry, 90: 735–741.
MOURE, A.; CRUZ, J.M.; FRANCO, D.; DOMÍNGUEZ, J.M.; SINEIRO, J.; DOMÍNGUEZ, H.; NÚÑEZ, M.J.; PARAJÓ, J.C. 2001. Natural antioxidants form residual sources. Food Chemistry, 72: 145-171.
PAULETTI, P.M.; CASTRO-GAMBOA, I.; SILVA, D.H.S.; YOUNG, M.C.M.; TOMAZELA, D.M.; EBERLIN, M.N.; BOLZANI, V.S. 2003. New antioxidant C-glucosylxanthone from the stems of Arrabidaea samydoides. Journal of Natural Products, 66: 1384-1387.
PEIXOTO SOBRINHO, T.J.S.; GOMES, T.L.B.; CARDOSO, K.C.M.; AMORIM, E.L.C. 2010. Otimização de Metodologia Analítica para o Doseamento de Flavonoides de Bauhinia cheilantha (Bongard) Steudel. Química Nova, 33 (2): 288-291.
PEREIRA, O.R.; SILVA, A.M.S.; DOMINGUES, M.R.M.; CARDOSO, S.M. 2012. Identification of phenolic constituents of Cytisus multiflorus. Food Chemistry, 131: 652–659.
ROBY, M.H.H.; SARHANA, M.A.; SELIMA, K.A.H.; KHALEL, K. I. 2013. Evaluation of antioxidant activity, total phenols and phenolic compounds in thyme (Thymus vulgaris L.), sage (Salvia officinalis L.), and marjoram (Origanum majorana L.) extracts. Industrial Crops and Products, 43: 827–831.
SOUSA, C.M.M.; SILVA, H.R.; VIEIRA-JR, G.M.; AYRES, M.C.C.; COSTA, C.L.S.; ARAÚJO, D.S.; CAVALCANTE, L.C.D.; BARROS, E.D.S.; ARAÚJO, P.B.M.; BRANDÃO, M.S.; CHAVES, M.H. 2007. Fenóis totais e atividade antioxidante de cinco plantas medicinais. Quimica Nova, 30(2): 351-355.










