ISBN 978-85-85905-10-1
Área
Produtos Naturais
Autores
Campos, I. (UFAM-ICET) ; Batista, A. (UFAM-ICET) ; Silva, R. (UFAM-ICET) ; Bento, K. (UFAM-ICET) ; Guimarães, A. (UFAM-ICET)
Resumo
A espécie Bertholletia excelsa Bompl é uma árvore nativa da Amazônia, que pode atingir até 50 m de altura. O estudo químico da espécie é direcionado principalmente para a amêndoa. Foram encontrados terpenos, fenólicos e flavonóides. O extrato bruto e frações de B. excelsa foram avaliados por meio de reações em tubos de ensaio e por cromatografia em camada delgada. Foram indicadas as presenças de taninos condensados e flavanonas. O extrato bruto e as frações acetato de etila, butanol, clorofórmio apresentaram capacidade de sequestro do radical estável DPPH com IC50 de 13,15; 9,93; 9,23; 88,9 e 33,87 µg/mL, respectivamente. As frações polares apresentaram as maiores atividades. Os resultados indicam o potencial da espécie para o encontro de substâncias com aplicação tecnológica
Palavras chaves
Lecythidaceae; Castanha-do-Brasil; Método DPPH
Introdução
As plantas medicinais têm sido usadas pelo homem no tratamento de uma ampla variedade de doenças, desde as grandes civilizações antigas, conforme evidenciam alguns manuscritos remanescentes (PHILLIPSON, 2001). Várias plantas têm sido utilizadas na medicina popular tradicional, porém, para a maioria delas, não são conhecidos a constituição química, a eficácia farmacológica, e os riscos de toxidez (MONAGHAN & TKACZ, 1990; SIANI et al., 2003). O estudo químico de espécies de Lecythidaceae conduziram a identificação de triterpenos pentacíclicos, saponinas, ácido elágico (CARVALHO, et al. 1998), ácido betulínico, compostos fenólicos, além do registro de alcalóides quinazolínicos (CAMPOS et al., 2005). A espécie Bertholletia excelsa Bompl., representante da família Lecythidaceae, conhecida como castanha-do-brasil, é uma espécie nativa de interesse econômico na Amazônia (CLEMENT, 2000; LOUREIRO et al., 1979). É uma árvore imponente que pode atingir até 50 m de altura (LORENZI, 2002), que se sobressai na floresta (SOARES et al., 1976). Os poucos estudos químicos encontrados na literatura acerca de B. excelsa se concentram principalmente no estudo da amêndoa. As substâncias fenólicas e flavonóides foram detectados nas amêndoas, na concentração de 169,2 mg/100g e 107,8 mg/100g, respectivamente. Foram encontrados, também, alfa e gama tocoferóis, esqualeno e os fitosteróides: β-sitosterol, estigmasterol e campesterol (YANG, 2009). As amêndoas são consumidas em todo mundo e têm sido associadas aos benefícios para a saúde humana para o sistema imunológico, como antiproliferativo e antioxidante (SOUSA et 2007). O objeto deste projeto foi analisar a presença de metabólitos secundários e avaliar a capacidade antioxidante de extrato bruto e frações do caule de B. excelsa.
Material e métodos
Os galhos de Bertholletia excelsa Bonpl foram coletados de espécime localizado nas proximidades de Itacoatiara. O material botânico foi submetido à extração sob refluxo com etanol a 70%. Em seguida, foi concentrado em evaporador rotatório para a retirada do solvente, até o volume de 1200 mililitros. O extrato foi divido em duas porções de 600 mililitros. Uma parte foi seca em banho-maria obtendo-se o extrato bruto (CBGI). A outra porção foi submetida ao fracionamento por partição líquido-líquido em ordem crescente de polaridade, como hexano (FBEBH-019), clorofórmio (FBEBC), acetato de etila (FBEBAC) e butanol (FBEBB) e concentrados. A prospecção fitoquímica realizada para a caracterização de fenois, flavonoides, saponinas e terpenos foram feitas em triplicata e analisadas através de ensaios cromáticos usuais, segundo MATOS (2009). A análise por cromatografia em camada delgada (CCD) foi direcionada para avaliar a presença de terpenos, fenólicos e flavonoides, utilizando reveladores específicos (GUIMARÃES 2005). A capacidade antioxidante do extrato e das frações foi avaliada segundo o método fotocolorimétrico descrito por MENSOR et al. (2001), utilizando o radical DPPH (2,2-difenil-1-picril-hidrazila).
Resultado e discussão
A partir do fracionamento obtiveram-se as frações FBEBAC-019, FBEBH-019, FBEBC-019, FBEBB-019 e FBEBHA-019. No ensaio para fenóis desenvolveu um precipitado de coloração esverdeado, indicativa de taninos condensados. O extrato bruto e as frações FBEBB E FBEBHA (resíduo hidroalcoólico) indicaram a ausência de flavanonóis, flavanonas, chalconas, auronas, antocianinas e Antocianidinas. Somente a FBEBAC apresentou coloração vermelho-laranja indicativa de flavanonas Tanto o extrato bruto quanto as frações não apresentaram coloração característica para a presença de catequinas. Para a caracterização de terpenos (Lieberman-Burchard), observou-se a cor verde clara somente na fração de acetato de etila (Tabelas 1 e 2).
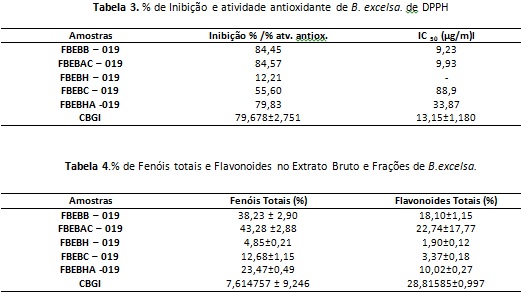
No ensaio por CCD de CBGI foram observadas fluorescências azuis Rf 0,82 e 068 indicativas para fenólicos no extrato bruto e para as frações, reveladas com NP/PEG. Na revelação com vanilina as placas motraram manchas azuis escuras com Rf 0,9; 0,8; 0,75. No ensaio de atividade antioxidante pelo método de DPPH(2,2-difenil-1-picril-hidrazila) o extrato CBGI inibiu o radical livre na concentração de 13,15µg/mL. A atividade continou sendo observadas nas frações FBEBC(IC50 88,9 µg/mL), FBEBAC(IC50 9,93 µg/mL), FBEBB (IC50 9,23 µg/mL), e FBEBHA (IC50 33,87 µg/mL). Somente a fração hexânica não apresentou capacidade antioxidante. Tabela 3 e 4.
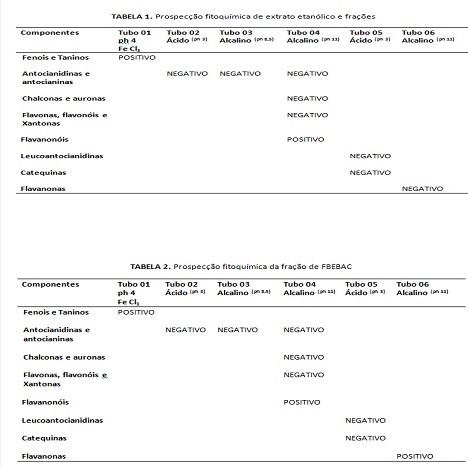
tabela prospecção quimica
fenois e flavonoites
Conclusões
A prospecção fitoquímica em tubo de ensaio permitiu caracterizar a presença de substâncias fenólicas e flavoides . O perfil cromatográfico indicou a presença substâncias fenólicas, porém não indicou a presença de flavonóides. O extrato bruto e as frações acetato de etila, butanol, clorofórmio apresentaram capacidade de sequestro do radical estável DPPH com IC50 de 13,15; 9,93; 9,23; 88,9 e 33,87 µg/mL, respectivamente. As frações polares apresentaram as maiores atividades. Os resultados indicam o potencial da espécie para o encontro de substâncias com aplicação tecnológica.
Agradecimentos
A Fundação de Amparo a Pesquisa do Amazonas (FAPEAM),aos integrantes do grupo de pesquisa de farmacognosia, e a minha família.
Referências
CAMPOS, F.R.; JANUÁRIO, A.H.; ROSAS, L.V.; NASCIMENTO, S.K.R.; PEREIRA, P.S.; FRANÇA, S.C.; CORDEIRO, M.S.C.; TOLDO, M.P.A.; ALBUQUERQUE, S. 2005. Trypanocidal activity of extracts and fraction of Bertholletia excelsa. Fitoterapia, 76: 26-29.
CARVALHO, M. G.; VELANDIA, J. R.; OLIVEIRA, L. F.; BEZERRA, F. B. 1998. Triterpenos Isolados De Eschweilera Longipes Miers (Lecythidaceae). Química Nova, 6: 740 – 743.
CLEMENT, C. R. Castanha-do-pará (Bertholletia excelsa). In: CLAY, J. W.; SAMPAIO, P. T. B.; CLEMENT, C. R. Biodiversidade Amazônica: exemplos e estratégias de utilização. 1 ed. Manaus: INPA, Programa de Desenvolvimento Empresarial e Tecnológico, 2000, p.119-131.
LORENZI, A. 2002. Árvores brasileiras: manual de identificação e cultivos de plantas arbóreas do Brasil. 4. ed. Nova Odessa, SP: Instituto Plantarum, v.1.
MATOS, F.T. 2009. Introdução à Fitoquímica Experimental. Fortaleza: UFC, 2009, 150p.
MENSOR, L. L.; MENEZES, F. S.; LEITÃO, G. G.; REIS, A. S.; DOS SANTOS, T. C.; COUBE, C. S.; LEITÃO, S. G. 2011. Screening of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method. Phytotherapy research, vol.15, p.127-13
MONAGHAN, R. L.; TKACZ, J. S. 1990. Bioactive Microbial Products: Focus upon Mechanism of Action. Annual Review of Microbiology, 44: 271 – 301.
Phillipson, J. D. 2001. Phytochemistry and medicinal Plants. Phytochemistry, 56: 237 – 243.
SOARES, L. P.; ROBERT, A. A. N.; CORAL, R. P. S.; REALE, V. B.; SILVA, O. P. 1976. Castanha do Brasil: levantamento preliminar. Belém: Federação da Agricultura do Estado do Pará, 69p
YANG, J. 2009. Brazil nuts and associated health benefits: a review. LTW-Food Science and Technology, in press, p. 1-8.










