ISBN 978-85-85905-10-1
Área
Química Verde
Autores
Alves da Silva, I. (UFRJ) ; José de Araújo Mota, C. (UFRJ)
Resumo
Com a motivação de reduzir a emissão de CO2 na atmosfera e de agregar valor a esta substância, este trabalho consistiu em converter CO2 através da sua hidrogenação, a hidrocarbonetos. Ao todo, 8 catalisadores foram preparados,caracterizados e testados em fluxo contínuo. Tais catalisadores são designados como: 5%Fe/Nb2O5; 15%Fe/Nb2O5;15%Fe15%Mn/Nb2O5;10%Fe10%Mn/Nb2O5;10%Fe5%Cu/Nb2O5;10%Fe5%Cr/Nb2O5; 5%Fe/5%Cr/Nb2O5 e 10%Fe5%Cr2%K/Nb2O5. A conversão de CO2 variou de 19% a 62%. Os produtos obtidos foram diversos hidrocarbonetos, em especial eteno e propeno,com uma seletividade máxima de 40%, além de CO e H2O.
Palavras chaves
Dióxido de Carbono; Aquecimento global; Catálise
Introdução
São alarmantes os dados atuais sobre a emissão crescente e a alta concentração de gases do efeito estufa na atmosfera, em particular o CO2, por ação antropogênica. O homem ainda depende de combustíveis fósseis, como a gasolina e o óleo diesel, por ser uma fonte relativamente de baixo custo de energia. Sabe-se que as fontes de energia renovável ainda têm um maior custo que os combustíveis derivados de petróleo[1]. Portanto, os renováveis continuam pouco competitivos no mercado, o que dificulta o seu consumo[2]. Contudo, diversos setores de produção como o industrial e o agrícola também tem sua parcela de culpa na emissão de poluentes. As mudanças climáticas e a qualidade do ar têm sido tratadas de maneiras distintas entre a ciência e a política. Os pesquisadores voltados para as mudanças climáticas alertam constantemente os chefes de estado dos riscos e do cenário atual do planeta em relação ao meio ambiente. Políticas pouco efetivas, com poucos países corroborando com medidas que tentam diminuir a emissão de poluentes atmosféricos, mostram que tais medidas têm sido pouco eficazes[3].A agência de oceanos e atmosfera dos EUA (NOAA) revelou em maio de 2013 que foi detectado 400,3 ppm de CO2 na atmosfera. Em abril de 2014 a concentração do dióxido de carbono permaneceu acima dos 400ppm durante todo o mês[4]. A concentração de CO2 nunca ultrapassou a marca de 300 ppm na atmosfera desde antes da revolução industrial, ocorrida a partir de 1780. A última vez que a concentração de CO2 na atmosfera chegou a 400 ppm foi a 15 milhões de anos[5]. A idéia de produzir hidrocarbonetos, através da hidrogenação de CO2, é porque a partir destes compostos pode se obter energia, ou ser utilizado na indústria petroquímica para a fabricação de plásticos, tais como PE e PP.
Material e métodos
REAGENTES - Nióbia,nitrato de Ferro (III) nonaidratado,nitrato de Cromo (III) nonaidratado,nitrato de Cobre (II) triidratado, nitrato de Manganês(II) didratado ,nitrato de Potássio anidro e água deionizada. Gases: 1CO2:5H2,1CO2:3H2,Ar Sintético,Hidrogênio e Hélio. MÉTODOS: Os catalisadores foram preparados por precipitação dos nitratos dos respectivos metais com adição de NaOH 1M, gota-a-gota até o pH 7, juntamente ao suporte de nióbia previamente calcinada a 600ºC . Um único catalisador contendo potássio foi preparado por impregnação úmida. Os catalisadores foram caracterizados por FRX, TPR e análise textural. Os testes catalíticos foram realizados em fluxo contínuo, a pressão atmosférica, com uma massa de 500mg de catalisador, sendo reduzido a 500ºC sob um fluxo de 30mL.min-1 de H2 puro. Após este procedimento inicia-se a reação com a passagem da mistura H2/CO2 nas proporções de 3:1 e 5:1, onde os produtos são analisados por um cromatógrafo a gás com detectores de ionização por chama(FID) e de condutividade térmica(TCD).
Resultado e discussão
CARACTERIZAÇÃO -
As caracterizações pela técnica de FRX revelaram que os teores de metais
obtidos experimentalmente foram muito próximos dos teóricos. Os perfis de TPR
dos catalisadores revelaram picos entre 400ºC e 600ºC, referentes a redução de
Fe3+ a Fe0. Os catalisadores contendo Cr e Mn apresentaram perfis com picos de
redução em torno de de 500ºC. O catalisador contendo Cu apresenta um pico
intenso em torno de 300ºC. O Nb e o K não se reduzem na faixa de temperatura
analisada (30ºC - 800ºC).
Os resultados de BET apresentaram áreas bem semelhantes que foram no
intervalo de 38 a 90 m2/g.
TESTES CATALÍTICOS -
Conforme a figura anexada, é possível observar que o aumento da temperatura
e a mistura mais hidrogenante favorecem a conversão do CO2, porém, desfavorece a
formação de olefinas, visto que o eteno e propeno formados podem ser mais
facilmente hidrogenados em um reator com maior excesso de H2.
O melhor catalisador para a produção de olefinas foi o Fe10%/Cr5%/K2%/Nb2O5,
visto que o potássio atua como um promotor eletrônico, estabilizando as ligações
π de olefinas, portanto foi possível obter uma seletividade de 40% a olefinas
com uma conversão de CO2 de 39% com a temperatura de 450ºC, pressão atmosférica
e vazão mássica de 30mL.min-1 da mistura H2/CO2 3:1. Ainda com o catalisador de
FeCr/Nb2O5 obteve-se 50% de conversão de CO2 a 500ºC e com o catalisador com o
menor teor de metal precipitado, ou seja, diferente do suporte, é possível
observar uma conversão de CO2 de 41%.
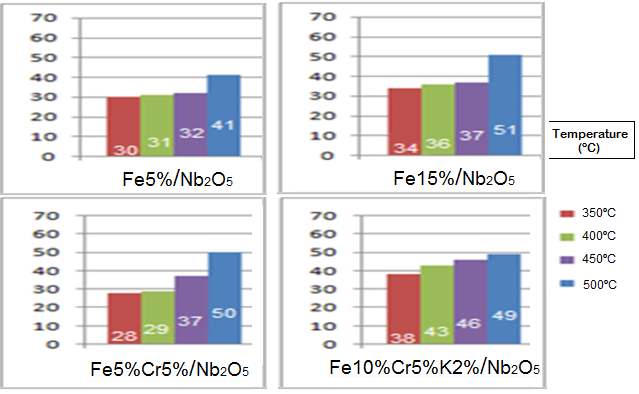
A figura apresenta a conversão percentual de CO2 nas 4 faixas de temperaturas estudadas.
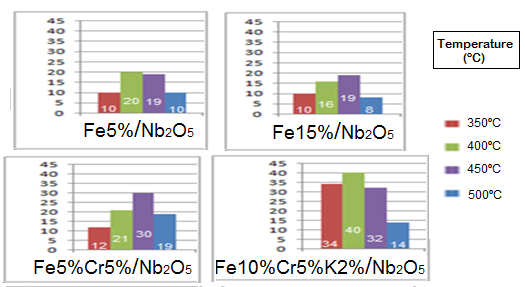
A figura apresenta a percentual de olefinas obtidos com a conversão do CO2 nas 4 faixas de temperaturas estudadas.
Conclusões
Os resultados obtidos foram satisfatórios, pois foi possível converter CO2 em todas as condições utilizadas. Para os catalisadores utilizados, as temperaturas ideais para a produção de olefinas foi de 400ºC e 450ºC. Quanto maior a temperatura, maior a conversão de CO2, visto que, a RWGS é uma reação endotérmica. A mistura mais hidrogenante, H2/CO2 =5:1 favorece a conversão de CO2 e a formação de metano,visto que o maior teor de H2 contribui diretamente para estes acontecimentos. O Óxido de Nióbio (V) mostrou-se um suporte catalítico onde é possível realizar a conversão de CO2.
Agradecimentos
Ao Cenpes/Petrobrás pela bolsa de mestrado.
Referências
[1]SONG, C.; Global challenges and strategies for control, conversion and utilization of CO2 for sustainable development involving energy, catalysis, adsorption and chemical processing, Catalysis Today, v.115, p.2, 2006
[2]PEZZO, C.R.; DO AMARAL, W.A.N.O papel do Brasil no estabelecimento do mercado internacional de biocombustíveis,Revista USP, São Paulo.v.75, p.18-31, setembro/novembro 2007
[3]MIKKELSEN, M.; JORGENSEN, M.; KREBS, F. C.; A review of fixation and transformation of carbon dioxide, Energy & Environmental Science, v.3, p.43-81, 2010.
[4]ÁVILA, F.; CO2 na atmosfera fica acima de 400ppm durante todo o mês de abril. Data da publicação : 02/05/2014. Disponível em: <http://www.institutocarbonobrasil.org.br/noticias2/noticia=736988> acesso em: 20/05/2014
[5]MONASTERSKY, R. Global carbon dioxide levels near worrisome milestone. Nature, v.497, p.13-14, 2013.
[6]Hirsa, M.T. G.; Bitter, J.H.; Khare, C.B.; Mathiijs, R.B.; Suported Iron nano particles catalysts for sustainable production of lower olefins; Science, 335, 885(2012).










