ISBN 978-85-85905-15-6
Área
Química Orgânica
Autores
Andrade, C.C. (UEG-UNUCET) ; Mendonça, T.L.F. (UEG-UNUCET) ; Mendonça, M.A.G. (UEG-UNUCET) ; Signini, R. (UEG-UNUCET) ; Naves, P.L.F. (UEG-UNUCET) ; Costa, M.B. (UEG-UNUCET)
Resumo
A quitosana principal derivado da quitina, apresenta várias de suas características principais, como sua baixa toxicidade e sua ação antimicrobiana. Dentre as possíveis reações existentes com a quitosana, a guanidilação tem se tornado um importante foco de pesquisa, devidos sua aplicação biológica e fácil solubilidade. O teste de letalidade com Artemia salina tem se tornado comum em teste biológicos, uma vez que o mesmo indica a toxicidade de um composto frente a micro- organismos e fornece o seu valor de IC50. Os ensaios de toxicidade foram realizados com dois compostos variando-se as concentrações que foram entre 500 a 31,25ppm. Os valores de IC50 de ambos compostos estão acima de 1000ppm, logo os mesmos não apresentam toxicidade significativa.
Palavras chaves
Quitosana; Quitosana-guanidinado; Artemia Salina
Introdução
Os micro-organismos patogénicos são responsáveis pela incidência de infecções humanas, nesse sentido as indústrias farmacêuticas vêm produzindo fármacos que inibam sua ação prejudicial ao nosso corpo. Entretanto, verificou-se que nas últimas décadas houve um aumento nos casos de resistência a estes fármacos, portanto iniciou-se uma busca por novas drogas com as mesmas atividades biológicas, sejam elas sintéticas, ou naturais, ou mesmo o melhoramento das propriedades das já existentes (LOGUERCIO et al. , 2005; MATASYOH et al., 2009). A pesquisa por novos fármacos se fundamenta na busca por novos protótipos e no planejamento de modificações estruturais da molécula, a fim de se adquirir novas substâncias com potencial bioatividade, visando à alta seletividade da ligação sem se perder sua atividade biológica (ANDRICOPULO, 2009). Estas pesquisas vêm se tornando um desafio para as indústrias farmacêuticas, sejam pelos elevados custos para seu desenvolvimento ou pela baixa biodisponibilidade e toxidade desses novos medicamentos. Tornando a procura de novas bioatividades, de medicamentos já comercializados, uma melhor fonte de pesquisa (CALIXTO; SIQUEIRA JUNIOR, 2008). A quitina é um polissacarídeo bastante encontrado na natureza, perdendo apenas para a celulose (ABREU et al., 2013). A quitosana(2) é o principal derivado da quitina, conserva algumas de suas características como a biocompatibilidade e atoxidade, porém apresenta melhoras quanto a sua solubilidade, principal desvantagem do uso da quitina, na qual em pH alcalino os grupos aminos livres podem ser protonados, tornando o polissacarídeo solúvel (VINSOVA; VAVRIKOVA, 2011) O uso de derivados de quitosana em medicamentos administrados por via intravenosa pode ser limitado, uma vez notado que estes derivados apresentam solubilidade apenas em meios levemente ácidos. Essa limitação está associada com sua faixa de solubilidade, uma vez que o pH fisiológico gira em torno de 7,4, logo há a possibilidade dos derivados da quitosana se precipitarem quando injetados na corrente sanguínea. No intuito de melhorar as limitações apresentadas pela sua solubilidade, é conveniente realizar reações químicas de forma que a quitosana possa conservar ou potencializar as propriedades existentes e ampliar a sua faixa de solubilidade (ZHAO‐SHENG et al., 2012). Entre as reações existentes, pode-se destacar as de fosfatação, sulfatação, carboxialquilação, quaternização, e guanidinilação, dentre outras (ROBERTS, 1992). Grupos guanidinicos(1) pode ser encontrada em muitos produtos naturais, isolados principalmente de algas, esponjas, etc. O grupo guanidínico apresenta uma alta basicidade, que o torna totalmente protonado a um pH fisiológico. Na forma de íon guanidínico funciona como reconhecedor de substratos aniônicos, tais como carboxilatos, fosfato e biomoléculas (ZHAO- SHENG et al., 2012). O grupo funcional guanidina desempenha um papel importante em sistemas biológicos, pois está presente em muitos compostos e apresenta uma vasta gama de atividades farmacológicas (LEVALLET et al. , 1997) Vários polímeros foram modificados via guanidinilação para melhorar a sua solubilidade e atividade bactericida, entre eles a quitosana. A literatura demonstra que a síntese de quitosanas reagidas com biguanidinas apresentou uma melhor ação como agente bactericida e possivelmente melhor faixa de solubilidade em água (ZHAO-SHENG et al., 2012; HU et al., 2007). O teste de toxicidade contra a Artemia salina é um bioensaio considerado como ferramenta para avaliar a toxicidade em um composto (HOCAYEN et al., 2012). A utilização deste organismo como indicador de toxicidade vem desde a década de 70. Muitas pesquisas, nas mais diversas áreas do conhecimento, têm à utilizado para avaliar a toxicidade aguda de ambientes degradados, como lençóis freáticos, solo, produtos químicos, através da sobrevida dos indivíduos expostos à essa condição nas mais variadas concentrações, por um determinado período de tempo (TEIXEIRA, 2008). Este ensaio auxilia na detecção da toxicidade do composto a ser analisado, de forma rápida, simples, econômico e de fácil reprodutibilidade (HIROTA et al., 2012). Por tanto, este trabalho objetiva realizar a avaliação da toxicidade de compostos quitosana-guanidinados frente ao ensaio com Artemia salina, além de determinar sua concentração mínima inibitória para matar metade dos crustáceos (IC50).
Material e métodos
A parte experimental foi executada na Unidade Universitária de Ciências Exatas e Tecnológicas (UnUCET) da Universidade Estadual de Goiás (UEG). Os reagentes e solventes P. A. (E. Merck, Aldrich Chemical Co., Fluka, Grupo Química, Vetec, Ecibra e Quimex) foram utilizados sem purificação prévia. Os ensaios foram realizados conforme método de Meyer e colaboradores (1982), com adaptações de Molina-Salinas & Said-Fernández (2006), que veio a padronizar este tipo de ensaio. Neste ensaio, foi-se empregado o meio de água marinha sintética preparado com a dissolução em água destilada de sal marinho (40 g L-1) suplementado com extrato de leveduras (6 mgL-1) e esterilizado em autoclave. O pH foi ajustado a 8,5 com solução de carbonato de sódio (Na2CO3) 0,1 mol -1. Cem miligramas dos cistos foram incubados por 36 horas em 500 mL do meio colocado próximo a uma lâmpada de 5 watts, com temperatura ambiente e oxigenação constantes. Após a eclosão, os náuplios foram atraídos por fonte de luz, pipetados e transferidos para uma placa de Petri com 5mL com meio fresco. O bioensaio foi realizado em microplaca de poliestireno estéril de 96 poços na qual adicionou-se diferentes concentrações (500, 250, 125, 62,5 e 31,25 ppm) dos compostos. Os compostos foram solubilizados em uma solução de Ácido Acético 1%, e neutralizados com Bicarbonato de Sódio 1%, até o pH ficasse entre 7-8. Posteriormente, foram solubilizados em solução salina e ajustado seu volume na concentração desejada. Os náuplios foram distribuídos na placa, padronizando um total de 10±1 de indivíduos em cada poço. Serão incluídos nos ensaios controles negativos, de viabilidade e de letalidade, utilizando as diluições citadas acima, de dicromato de potássio (K2Cr2O7). Os resultados permitirão o cálculo da CL50 pelo método gráfico para dose-resposta – Próbito, no programa Statistica10 criado pela Statsoft. Todos os ensaios realizados serão feitos em triplicata e de maneira independente.
Resultado e discussão
As amostras foram solubilizadas em solução de Ácido Acético 1%, uma vez que
tanto a quitosana quanto seus derivados apenas se solubilizam em meio ácido.
Tornando, essa característica um dos principais fatores que possam
influenciar no ensaio de letalidade.
As triplicatas foram realizadas em datas e ambientes diferentes, observando-
se assim a influência que o meio poderia causar no resultado dos testes.
O ensaio com o branco, no qual utilizou-se apenas a solução salina,
apresentou mortalidade abaixo de 10%, demostrando assim que a solução
utilizada não influenciou no resultado dos testes, uma vez que essa solução
apenas tinha a função de servir como meio de eclosão e crescimento da
Artemia.
O controle, que possui a capacidade de matar as larvas do crustáceo, obteve
alta toxicidade, matando um elevado número de larvas, possuindo um valor de
IC50 de 130ppm.
A determinação da toxicidade dos compostos leva em consideração que
compostos que apresentam valores de CL50<1000ppm apresentam certa
toxicidade frete a Artemia salina (MEYER et al., 1982). No
qual são considerados com baixa toxidade os que apresentam CL50
entre 250 e 1000ppm, já extratos com CL50 entre 250 e 80ppm são
considerados moderadamente tóxicos, e com CL50 abaixo de 80pmm
altamente tóxicos (DOLABELA, 1997).
Logo, como os dois compostos analisados apresentaram valores de concentração
mínima inibitória acima de 1000ppm, é conveniente dizer que ambos os
compostos não são tóxicos, uma vez que a quitosana utilizada como base para
a formação desses compostos, não apresenta toxicidade frente ao mesmo
crustáceo.
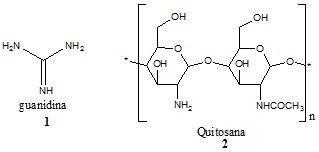
Estrutura do grupo funcional guanidina e o monômero da quitosana.
Conclusões
O presente trabalho concluiu que a análise da toxicidade de derivados quitosana-guanidinilados frente a Artemia salina foi satisfatório e determinou-se que ambos os compostos apresentam baixa toxicidade, abrindo assim, a possibilidade de síntese de novos derivados e sua utilização em testes para verificação de sua possível atividade biológica. Porém, ainda é necessário um estudo e aprimoramento desta técnica em relação ao seu uso com derivados poliméricos de quitosana, uma vez que sua faixa de solubilidade é limitada.
Agradecimentos
Agradeço a CAPES pelas bolsas fornecidas e a Universidade Estadual de Goiás por todo o suporte fornecido.
Referências
ABREU, F. O. M. S.; CAVALCANTE, L. G.; DOUDEMENT, P. V.; CASTRO, A. M.; NASCIMENTO, A. P. D.; MATOS, J. E.; Propriedades e características da quitosana obtida a partir do exoesqueleto de caranguejo-uçá utilizando radiação de microondas. Polímeros, v.23, n.5, 630-635,2013.
ANDRICOPULO, A. D.; SALUM, L. B.; ABRAHAM, D. J.; Structure-based drug design strategies in medicinal chemistry. Current Topics in Medicinal Chemistry, v. 9, n. 9, p. 771-790, 2009.
CALIXTO, J. B.; SIQUEIRA JUNIOR, J. M.; Desenvolvimento de medicamentos no Brasil: desafios. Gazeta Médica da Bahia, v. 78, n. 1, 2008.
DOLABELA, M. F. Triagem in vitro para atividade antitumoral e anti-Tripanossoma cruzi de extratos vegetais, produtos naturais e substancias sintéticas. UFMG, 1997, 128f. Dissertação de Mestrado, Universidade Federal de Minas Gerais, Belo Horizonte, 1997.
HIROTA, B. C. K.; PAULA, C. S.; MIGUEL, O. G.; MIGUEL, M. D. Avaliação de toxidade in vitro: aplicabilidade do ensaio de letalidade frente á Artemia salina. Visão Acadêmica, v.12, n.2, p.42-48, 2012.
HOCAYEN, P. D. A. S., CAMPOS, L. A., POCHAPSKI, M. T., & MALFATTI, C. R. M. Avaliação da Toxicidade do extrato bruto metanólico de Baccharis dracunculifolia por meio do bioensaio com Artemia salina. INSULA Revista de Botânica, n. 41, p. 23-31, 2012.
HU, Y.; DU, Y.; YANG, J.; KENNEDY, J. F.; WANG, X.; WANG, L.; Synthesis, characterization and antibacterial activity of guanidinylated chitosan. Carbohydrate Polymers, v. 67, n. 1, p. 66-72, 2007.
LEVALLET, C.; LERPINIERE, J.; KO, S. Y.; The HgCl< sub> 2</sub>-promoted guanylation reaction: The scope and limitations. Tetrahedron, v. 53, n. 14, p. 5291-5304, 1997.
LOGUERCIO, A. P.; BATTISTIN, A.; VARGAS, A. C. D.; HENZEL, A.; WITT, N. M.; Atividade antibacteriana de extrato hidro-alcoólico de folhas de jambolão (Syzygiumcumini (L.) Skells). Ciência Rural, v. 35, n. 2, p. 371-376, 2005.
MATASYOH, J. C.; MAIYO, Z. C.; NGURE, R. M.; CHEPKORIR, R.; Chemical composition and antimicrobial activity of the essential oil of<i>Coriandrumsativum</i>. Food Chemistry, v. 113, n. 2, p. 526-529, 2009.
MEYER, B. N., FERRIGNI, N. R., PUTNAN, J. E., JACOBSEN, L. B., NICHOLS, D. E., Mcl. AUGHLIN, J. Brine shrimp: A convenient general bioassay for active plant constituents. Journal of Medical Plant Research, v. 45, n.1, p. 31-34, 1982.
MOLINA-SALINAS, G. M., & SAID-FERNÁNDEZ, S. A modified microplate cytotoxicity assay with brine shrimp larvae (Artemia salina).Pharmacology online, v. 3, p. 633-8, 2006.
TEIXEIRA, J. Avaliação dos efeitos tóxicos e genotóxicos do inseticida imidacloprido em Artemia salina e Allium cepa L. Monografia, Criciúma, UNESC, 51p, 2008.
VINSOVA, J.; VAVRIKOVA, E.; Chitosan derivatives with antimicrobial, antitumour and antioxidant activities-a review. Current pharmaceutical design, v. 17, n. 32, p. 3596-3607, 2011.
ZHAO‐SHENG, C.; YUE‐MING, S.; CHUN‐SHENG, Y.; XUE‐MEI, Z.; Preparation, characterization, and antibacterial activities of para‐biguanidinyl benzoyl chitosan hydrochloride. Journal of Applied Polymer Science, v. 125, n. 2, p. 1146-1151, 2012.


















