ISBN 978-85-85905-15-6
Área
Química Orgânica
Autores
dos Santos Filho, J.M. (UFPE) ; Leite, L.F.C.C. (UNICAP) ; Pinheiro, S.M. (UFPB) ; Almeida, W.P. (UNICAMP)
Resumo
A doença de Alzheimer (AD) é a forma mais comum de demência entre pessoas idosas e a patogênese dessa doença é associada ao estresse oxidativo. Inibidores da acetilcolinesterase (AChE) com atividade antioxidante são considerados compostos potencialmente ativos no seu tratamento. Derivados N- acil-hidrazona (NAH) têm sido explorados como agentes promissores no combate à doença de Alzheimer, de modo que a série de derivados piperon-5-il-N-acil- hidrazona foi selecionada para os estudos preliminares na determinação do papel desses compostos na descoberta de novas drogas com aplicação no tratamento dessa enfermidade.
Palavras chaves
N-acil-hidrazonas; Acetilcolinesterase; Doença de Alzheimer
Introdução
A química de N-acil-hidrazonas é uma área de intensa pesquisa, sobretudo devido ao amplo espectro de atividades biológicas apresentadas por estas substâncias[1]. Derivados piperon-5-il-N-acil-hidrazona foram sintetizados em nosso grupo de pesquisa e sua atividade biológica tem sido explorada extensivamente, sobretudo como antiparasitários[2]. Recentemente estes compostos de características estruturais peculiares atraíram o interesse do nosso grupo como potenciais inibidores da acetilcolinesterase e como modelo para o estudo das relações estrutura atividade (SAR) em modelos in vitro de inibição desta enzima associada à atividade antioxidativa. Os compostos de interesse foram originalmente sintetizados em nosso grupo como misturas de isômeros E/Z e recentemente obtidos exclusivamente como o isômero E sob condições catalíticas brandas na presença de cloreto de cério (III) num aperfeiçoamento da síntese clássica desenvolvido em nosso grupo[3]. A doença de Alzheimer foi reportada pela primeira vez pelo neurologista alemão Alois Alzheimer em 1907 e apenas nas últimas duas décadas foi estabelecida a relação entre a doença e a deficiência de acetilcolina (ACh). O uso da teoria da inibição enzimática no diagnóstico e no planejamento de novas drogas é uma importante ferramenta na Química Medicinal e ajuda a otimizar o trabalho de síntese e avaliação biológica. Uma vez que a terapia colinérgica pode alterar os sintomas e progresso da AD interrompendo o decréscimo de ACh, o alvo molecular natural para este fim é a enzima AChE. Estudos recentes têm apontado as N-acil-hidrazonas como potenciais inibidores da AChE[4], tornando os compostos piperon-5-il-N-acil-hidrazona uma promessa neste campo da Química Medicinal.
Material e métodos
Todos os produtos foram sintetizados pela rota descrita anteriormente em nosso grupo[2]. Análises de ressonância magnética de hidrogênio (1H-RMN) foram realizadas a 400 MHz, determinando o isômero E como única estrutura presente. Os ensaios para avaliação da atividade anticolinesterásica foram realizados segundo o método colorimétrico de Ellman et al.[5], utilizando a acetilcolinesterase (AChE) de Electrophorus electricus (electric eel)-Type VI-S (Sigma-Aldrich). A enzima foi ressuspensa em tampão Tris/HCl, 50 mmol.L-1, pH 8 e diluída até uma concentração final de 1U/mL. O reagente de Ellman foi preparado diluindo-se ácido 5,5´-ditiobis-2-nitrobenzóico (DTNB) em tampão Tris/HCl (1 mmol.L-1). Iodeto de acetiltiocolina 0,8 mM (ATC; Aldrich Chem. Co.) foi utilizado como substrato e Tacrina, um inibidor da AChE, como controle positivo. Todos os experimentos foram feitos em triplicata. Os resultados foram expressos em percentual de inibição e a concentração inibitória mínima para reduzir a atividade enzimática em 50% (CI50 ou IC50) foi calculada utilizando-se o programa Graph Pad Prisma. Os ensaios para avaliação do potencial antioxidante foram baseados no método ligeiramente modificado por Brand-Williams et al.[6]. Este ensaio se baseia na medida da capacidade antioxidante de uma determinada substância em sequestrar o radical DPPH reduzindo-o a hidrazina. A eliminação de radicais de compostos sintéticos contra o hidrato estável de 2,2-difenil-2- picrilhidrazil (DPPH•) foi determinado por espectrofotometria, usando-se espectrofotômetro UV-visível a 515 nm. Ácido ascórbico foi utilizado como padrão. A diminuição na absorbância a 515 nm foi determinada no tempo 0 e 10 min depois. Os resultados forma expressos em porcentagem de atividade antioxidante.
Resultado e discussão
A série piperon-5-il-N-acil-hidrazona utilizada para este estudo é mostrada
na Figura 1. Seguindo o comportamento geral de hidrazonas sintetizadas sob
catálise de CeCl3, todos os produtos foram obtidos exclusivamente como
isômeros E, tornando a avaliação das atividades biológicas mais precisa,
assim como as avaliações teóricas requeridas para se promoverem modificações
moleculares bem-sucedidas.
Os derivados piperon-5-il-N-acil-hidrazona apresentaram resultados
promissores na inibição da AChE, constituindo-se os valores da IC50 (μM)
para R = Cl e Br de 0,17 e 0,12 respectivamente numa resposta positiva às
expectativas existentes com bases no perfil de atividade desses compostos.
Estes dados sugerem a necessidade de se introduzirem modificações
moleculares envolvendo a substituição de grupos funcionais e/ou
simplificação molecular, delineando-se as relações estrutura-atividade de
outros análogos, a fim de se otimizar a atividade anti-AChE. Por outro lado,
os resultados da atividade antioxidativa foram mais modestos, evidenciando a
necessidade de se avaliar com rigor quais estruturas análogas devem ser
planejadas e sintetizadas na sequência de um projeto de pesquisa mais amplo.
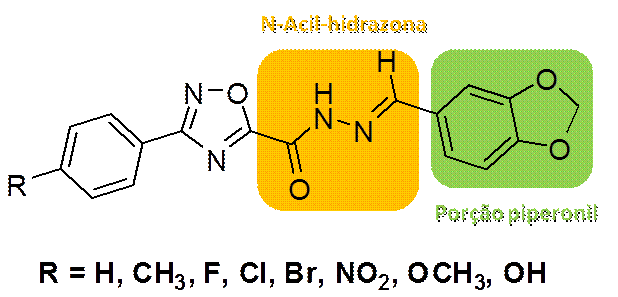
Figura 1. Série piperon-5-il-N-acil-hidrazona.
Conclusões
A atividade anti-AChE dos derivados piperon-5-il-N-acil-hidrazona estudados neste trabalho permitiu determinar um novo perfil de moléculas a ser submetidas ao planejamento e modificação estruturais com base nos princípios da Química Medicinal e que podem eventualmente levar a novas drogas de interesse no tratamento da doença de Alzheimer. O esqueleto NAH se mostrou, mais uma vez, uma estrutura privilegiada também no ataque a alvos moleculares envolvidos em doenças do sistema nervoso central, possibilitando o desenvolvimento de inúmeros estudos de SAR baseados no planejamento racional.
Agradecimentos
Os autores são gratos à equipe da Central Analítica do Departamento de Química Fundamental da UFPE pelas análises espectroscópicas.
Referências
[1] Padmini et al., Int. J. Pharma Res. Rev., 2013, 2(8), 43-58.
[2] dos Santos Filho et al., Bioorg. Med. Chem., 2012, 20, 6423-6433.
[3] dos Santos Filho, J. M., Eur. J. Org. Chem., 2014, 6411–6417.
[4] Gwaram et al., Molecules, 2012, 17, 2408-2427.
[5] Ellman, G.L., Arch. Biochem. Biophys. 1959, 82, 70-77.
[6] Brand-Williams, W. et al., Lebensmittel-Wissenschaft und-Technologie/Food Science and Technology, 1995, 28, 25-30.


















