ISBN 978-85-85905-15-6
Área
Química Orgânica
Autores
Vasconselos, G.T.S. (UFPE) ; Silva, I.M. (FACULDADE DE BELO JARDIM) ; Araujo, R.O. (UFPE) ; Sena, K.X.F.R. (UFPE) ; Albuquerque, J.F.C. (UFPE)
Resumo
A síntese e o planejamento de fármacos são ferramentas da química medicinal na busca de produtos bioativos. Isso se dá por modificação de reações orgânicas de produtos com atividade biológica previamente conhecidas. As tiazolidina se enquadram nessa lista por serem portadores de diversas atividades. Neste sentido, um novo derivado tiazolidínico, 5-(3- metoxibenzilideno)-tiazolidina-2,4-diona (Ju-403) foi sintetizado a partir da reação entre tiazolidina-2,4-diona e aldeído por reação de Knoevenagel. Após purificação sua estrutura química foi confirmada pelos métodos espectroscópicos convencionais de Infravermelho (IV), Ressonância Magnética Nuclear de Hidrogênio e Carbono Treze (RMN1H e RMN13C) como também foram determinados os dados seguintes: ponto de fusão, fator de retenção e rendimento.
Palavras chaves
Tiazolidina-2,4-diona; Tiazolidinona; Arilidenos
Introdução
Derivados tiazolidínicos e seus análogos estruturais são moléculas potencialmente ativas que vêm sendo estudadas devido as suas propriedades biológicas principalmente antimicrobianas e parasitológicas. Várias mortes ao redor do mundo têm sido causadas principalmente por esses dois tipos de doenças. A humanidade, parasitas e micróbios têm vida em comum certamente desde a pré-história. Por muitos séculos o combate a doenças causadas por estes parasitos ou micróbios era sanada por plantas, algas ou alguns animais marinhos. Com o surgimento da Química como ciência, os pesquisadores nos dois últimos séculos começaram a desenvolver algumas substâncias e testa-las contra diversas doenças. Vários núcleos heterocíclicos foram desenvolvidos e testados contra esses males principalmente aqueles causados por micróbios ou parasitas e ultimamente por insetos. Os derivados da tiazolidina são moléculas potencialmente ativas e estão incluídos entre estes núcleos. Seus derivados vêm sendo desenvolvidos em diversas partes do mudo com a finalidade de sanar estes males. Levando em conta esse potencial, diversos compostos tiazolidínicos vêm sendo sintetizados e testados em relação às atividades antiproliferativa, analgésica, antifúngica e antibacteriana. Vários derivados sintetizados apresentaram ações diversas como analgésica, antipirética, anti-inflamatória, antitumoral, antibiótico, antifúngica, antibacteriana e outras (GORCZYNSKI et al., 2004; AMR et al., 2009). A variação ou modificação molecular é um dos métodos de estudo usado para obtenção e para planejar a síntese de vários e novos compostos. Este método realiza mudanças estruturais na molécula original, criando uma série de derivados análogos que permitem avaliar a atividade biológica exercida pela droga original (KOROLKOVAS, 1982).
Material e métodos
Em um balão de fundo redondo foram pesados e cuidadosamente adicionados 0,0584 g (0,00049 mols) de tiazolidina-2,4-diona (Ju-32) anteriormente sintetizada pela equipe do nosso laboratório, 2 mL de etanol e 2 gotas de piperidina como catalisador. A mistura foi deixada em agitação magnética durante uma hora, à temperatura ambiente para formação do ânion na posição 5 do anel tiazolidínico como também para facilitar o ataque deste ao benzaldeido na segunda etapa da reação. O 3-metoxi-benzaldeído 0,1 mL (0,00049 mols) foi adicionado lentamente ao balão. A reação foi conduzida ao ultrassom a 60 °C e não houve necessidade de ser acompanhada por cromatografia em camada delgada porque logo que foi submetida ao ultrassom houve uma turvação e foi constatada reação imediata. Após esta observação foi confirmado por meio de cromatografia de camada delgada que a reação havia sido completada. Após este período a reação foi vertida em um béquer para cristalizar e deixada sobre a bancada durante 24 horas. Depois de cristalizada, o produto foi filtrado com um funil de Buckner sinterizado e os cristais lavados várias vezes com água seguida de etanol gelado para retirar todas as impurezas que poderiam ter sido formadas durante a reação. O produto foi submetido a uma cromatografia de camada delgada e comparado com a água mãe para verificar que realmente não tinha nenhum traço de impureza. Após esse procedimento o produto foi levado à estufa com a temperatura controlada a 37 °C para secagem durante três horas consecutivas. Após secagem os cristais obtidos foram submetidos a ponto da fusão com a finalidade de verificar a sua pureza. Em seguida foram pesados, colocados em um vidro de penicilina e determinado sua solubilidade e todos os dados seguintes (ponto de fusão, rendimento, Rf e sistema).
Resultado e discussão
Os resultados apresentados pelo produto reacional puro foram os seguintes:
Ponto de Fusão. 181-183 ºC, Rf 0,51 no sistema (hexano e acetato de metila
na seguinte proporção 0,7:0,3). O rendimento foi de 13 %, que foi
considerado muito baixo. O processo foi realizado com quantidades
equimolares dos reagentes, tendo estes reagido imediatamente à temperatura
ambiente, ou seja, não houve gasto de água (necessária quando a reação se
processa com refluxo) e nem de energia. A não utilização desses dois itens
deixa o processo mais barato, tanto do ponto de vista econômico como
ambiental. Foram realizados os espectros de Ressonância Magnética Nuclear de
Hidrogênio e Carbono treze e de Infravermelho. Para o IV os principais
sinais foram (cm–1, KBr 1 %,) 3236,22 (N–H); 1292,52 e 1241,32 (C-O2 e C-
O4). No RMN1H (300 MHz, DMSO-d6, δ, ppm) os picos foram em , 7,64 (s, 1H,
Ar); 8,05 (d,d 1H, Ar J= 7,50; J= 2,32), 7,35 (d, 1H, Ar, J= 7,56); 7,75 (t,
1H, Ar J=7.45); 11,54 (s, 1H, N-H). 8,18 (s 1H CH=) 3,87 (s 3H, OCH3). Para
o RMN 13C e DEPT (75,5 MHz, DMSO-d6, δ, ppm), foram observados 56,8 (O-CH3);
169,5 C=O(2) 167,9 (C=O(4); 145,3 CH=C, 139,8; 115,18; 163,5; 114,9; 123,1
127,2 (aromáticos). No (IV) as absorções das carbonilas e do NH
caracterizaram o composto. No NMR1H ficaram claros os picos do grupo OCH3 em
3,77, a dupla ligação com absorção em 8,78, inclusive definiu a conformação
Z do composto, e as absorções do NH e do anel aromático. No carbono treze a
absorção da metoxila, das carbonilas nas posições 2 e 4, da dupla ligação
carbono-carbono e também do anel aromático foram definitivas para a
identificação de todos os carbonos. O espectro de massa apresentou o PM em
235,0303. A análise elementar foi determinada para complementar a estrutura
com os dados C 56,17; H 3,87 e N 5,97%.
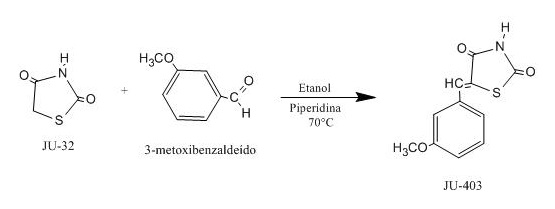
Reação de síntese de 5-(3-metoxibenzilideno)- tiazolidina-2,4-diona (Ju-403)
Conclusões
O composto foi sintetizado dentro das normas planejadas. A reação foi rápida, sem gastos de água e energia contribuindo para o meio ambiente. A estrutura química foi determinada pelos métodos espectroscópicos de RMN1H, RMN13C, e Infravermelho. Também foram determinados o rendimento, Rf e ponto de fusão. A reação foi processada imediatamente à adição dos reagentes produzindo cristais brancos. O derivado apresentou um produto com rendimento abaixo do esperado. O próximo passo será a melhora do rendimento e realização de testes para avaliar as atividades anticâncer e antimicrobianas do composto.
Agradecimentos
Ao PIBIC/CNPq pela bolsa de Iniciação científica concedida, pelo apoio recebido e pelo projeto aprovado. Também a Central analítica do Departamento de Q. Fundamental
Referências
AMR, A. El-Galil E.; SABRRY, N. M.; ABDALLA, M. M.; ABDEL-WAHAB, B. F. Synthesis, antiarrhythmic and anticoagulant activities of novel thiazolo derivatives from methyl 2-(thiazol-2-ylcarbamoyl)acetate, European Journal of Medicinal Chemistry, v 44, p 725-735, 2009.
GORCZYNSKI, M. J.; LEAL, R. M.; MOOBERRY, S. L.; BUSHWELLERA, J. H.; BROWNA, M. L.. Synthesis and evaluation of substituted 4-aryloxy- and 4-arylsulfanyl-phenyl-2-aminothiazoles as inhibitors of human breast cancer cell proliferation, Bioorganic & Medicinal Chemistry, v 12, p 1029-1036, 2004.
KOROLKOVAS, A. l.; BURCKHALTER, J. H. Química Farmacêutica, Rio de Janeiro, Ed. Guanabara Dois, 1982, 783 p.


















